




引言
今日分享发表在world journal 的一则案例。在临床中,研究者应用脐带间充质干细胞成功治疗了1例银屑病患者。患者在2周内接受了3轮脐带间充质干细胞治疗。结果显示红斑逐渐消失。在干细胞治疗3个月后,这位银屑病病人的主观和客观指标都得到了改善,所有红斑完全消失,银屑病无复发。并且经脐带间充质干细胞移植治疗的银屑病患者的PASI评分在第一次移植后122天从9.9下降到1.7。在此期间,患者的DLQI评分从27降至3,证实了生活质量的显著改善。这1案例报道再次为间充质干细胞治疗银屑病提供了临床证据。
银屑病,俗称牛皮癣,是一种无法治愈的自身免疫性疾病,表现出广泛的临床症状。银屑病典型表现为表皮呈红色鳞状,硬化,基底角化细胞过度增生。这种严重的皮肤状况最常见于头部、上肢、手部、躯干和下肢,并且它可以出现在任何部位。世界上约2%的人口患有牛皮癣[1]。尽管治疗牛皮癣的治疗方案多种多样,但目前尚无明确的治愈方法[2-4]。这种疾病严重影响患者的生活质量,随疾病的进展可能危及生命。

间充质干细胞(MSCs)因其具有抗炎症和免疫调节的作用,并且以往关于MSCs在自身免疫性疾病患者中的有效性均得到证实[5-8]。因此,间充质干细胞治疗银屑病的研究逐渐备受关注。
案例:银屑病患者就医25年,终于脐带间充质干细胞带来希望
发表在world journal的病例报道中[27],一名47岁的男性患者,1995年确诊为牛皮癣。他接受了25年的各种治疗,但银屑病的病情并没有明显好转。

后来,这名患者接受了间充质干细胞治疗。2020年4月1日,患者来就诊。当时的症状是手指、手背、两只手腕和两只耳朵都有炎症。红斑广泛分布于双手、全指及双腕。耳廓内侧和耳垂下部也有红斑(图1A和B)。患者还主诉发痒。
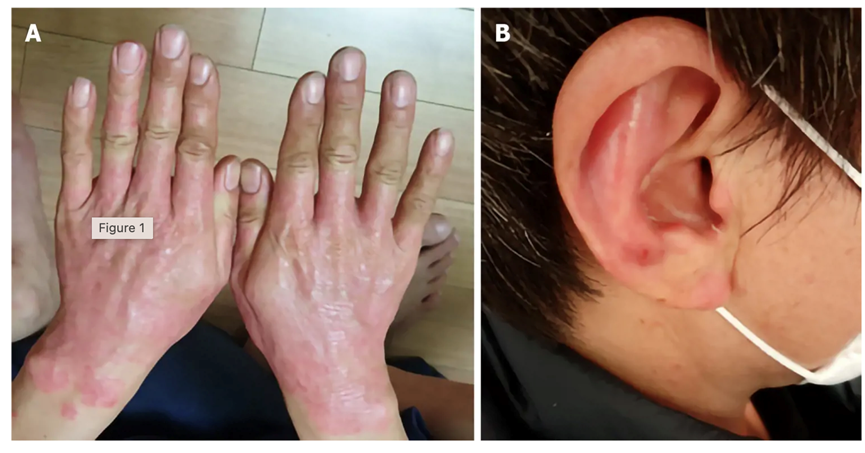
图1治疗前银屑病病变部位。A:脐带间充质干细胞移植前手部和手腕的牛皮癣病变部位;B: 脐带间充质干细胞移植前的耳部。
他在2周内接受了三轮脐带间充质干细胞治疗,结果红斑逐渐消失。第治疗3个月后,所有红斑完全消失,牛皮癣无复发。
在这个案例中,研究人员对脐带间充质干细胞进行分离、评估和制备,确保所提取的细胞是安全的,没有受到微生物或外来病毒的污染。
在临床治疗当中,研究者将含有间充质干细胞注射溶液对患者进行静脉移植和局部移植。患者的治疗前情况如下:
一、治疗方案
(1)采用含有脐带间充质干细胞的注射液静脉移植。
静脉移植时,间充质干细胞以3 × 10^6个/mL的浓度置于0.9%生理盐水中。将含有带间充质干细胞的10 mL注射溶液与100 mL 0.9%氯化钠注射液(USP)混合。然后,将110 mL的混合物静脉移植1-1.5小时。移植结束后,立即重复相同的过程。
(2)采用含有带间充质干细胞的注射溶液局部移植。
局部移植时,将间充质干细胞以1 × 10^6个/mL的浓度置于0.9%生理盐水中。
制备12支含有注射液的Ultra-FineTM II胰岛素注射器。每只装有注射液的注射器在病变内和周围注射0.25 mL,间隔2 cm。每只手、手腕注射液4 mL,每只耳朵注射液1 mL,面部注射液2 mL。第2、3轮仅局部移植,每隔1周进行一次。
二、治疗结果
研究者采用银屑病面积及严重程度指数(psoriasis Area and severity Index, PASI)和皮肤病生活质量指数(Dermatology Life Quality Index, DLQI)对患者银屑病的严重程度进行评估[16]。结果证实,间充质干细胞有效治疗银屑病安全有效。
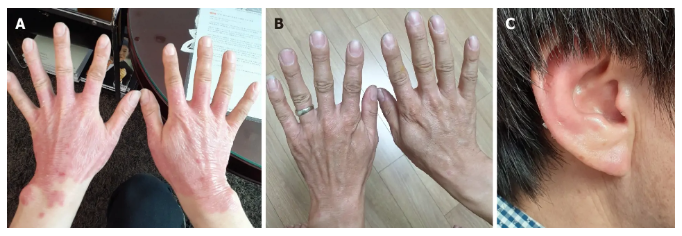
备注:患者在治疗期间和治疗后病变部位的可见变化。A、B:第一次移植后第15天(A)和第122天(B)观察双手和手腕红斑变化;C:第一次移植后122天耳部病变部位的红斑。
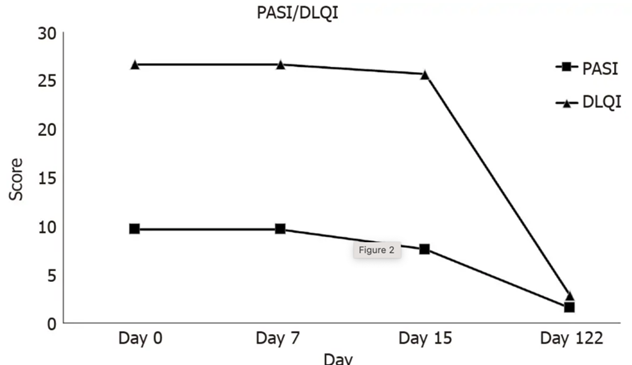
在2020年4月1日第一次就诊时,使用PASI和DLQI诊断银屑病严重程度。PASI得分为9.9分。确定银屑病程度不严重,但DLQI评分为27分,表明该皮肤病对日常生活的影响很大。
经过脐带间充质干细胞移植后的122 天,患者的PASI和DLQI评分分别从9.9降至1.7和27降至3(图2)。在5个月的随访期间,患者没有副作用和复发。病人的生活质量得到显著改善。
图片来自doi: 10.12998/wjcc.v9.i23.6798
研究人员得出结论:从PASI和DLQI评分来看,脐带间充质干细胞移植治疗银屑病效果显著。未来在引入这种安全有效的银屑病治疗方法之前,需要更多患者的临床试验和更长的随访时间。
间充质干细胞治疗银屑病机制
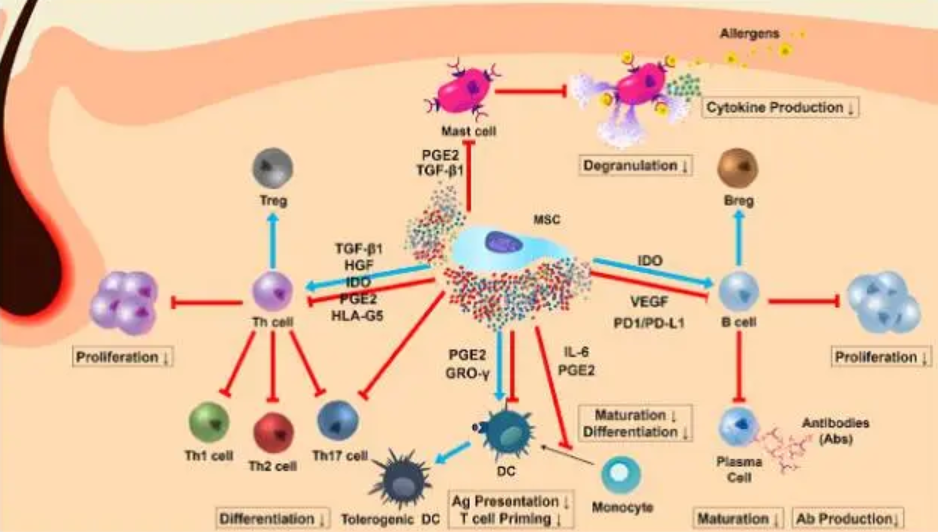
间充质干细胞作为一种多能干细胞,具有抗炎症和低免疫原性的特点,并且它们具有免疫抑制作用而没有风险。在银屑病的治疗中,MSCs的应用主要基于以下几个方面的机制。
1. MSCs 对 Th17/ Treg 平衡的调节作用
在银屑病疾病进程中,辅助性 T 细胞 17(Th17)/调节性 T 细胞(Treg)失衡是导致银屑病免疫功能紊乱关键环节[18]。MSCs 对 Th17/Treg 平衡具有强大的调节作用,能抑制树突状细胞(DCs)抗原的呈递,促进 T 细胞向 Treg 细胞分化,导致Th17/Treg 比例下降[19]。因而,MSCs 可能通过调节 Th17/ Treg 平衡而影响银屑病的发生和发展。
图片来源:https://doi.org/10.3390/ijms18020244
2.正常皮肤和银屑病皮损来源 MSCs 的生物学作用
研究发现,健康供体皮肤来源 MSCs(HMSCs)与银屑病患者皮损来源 MSCs(PsO-MSCs)共培养后,炎症细胞因子水平在共培养的PsO-MSCs 中显著低于单独培养的 PsO-MSCs[20],表明健康皮肤来源间充质干细胞对银屑病患者皮损来源间充质干细胞产生“积极”影响。
3. MSCs 及外泌体的免疫调节作用
MSCs 衍生的胞外囊泡(EV),包括外泌体(Exo)和微泡(MV),在细胞间信号传导和物质传递中发挥作用。研究人员发现[23]发现 IFN-γ 刺激间充质干细胞衍生的外囊泡可以减轻银屑病症状,降低炎症因子在脾脏和皮肤病变中富集。皮下注射 EVs 可降低皮肤病变中炎性细胞因子的水平[24]。通过向银屑病小鼠模型皮损中注射人脐带间充质干细胞外泌体,可降低银屑病皮损面积和严重程度指数(psoriasis area and severity index, PASI)评分 [25]。此外,还有研究揭示,间充质干细胞外泌体可能通过抑制角质层中的补体激活,减少中性粒细胞释放 IL-17[26]。
小结
银屑病作为一种慢性、复发性、炎症性皮肤病,给患者带来了生理、心理、经济等方面的多重负担,一直被人们广泛研究。世界范围内银屑病的患病率为 0.09%~11%[1],尚无根治的方法,且常伴发心血管疾病、代谢性疾病和肿瘤等重大疾病,严重影响患者的身心健康。随着间充质干细胞疗法的引入,在一定程度上打破了银屑病治疗困境,间充质干细胞凭借其强大的免疫调节特性,及时纠正银屑病患者体内失衡的免疫状态。目前,已经有越来越多的干细胞治疗银屑病的临床研究正在开展中,并且相继发表的临床结果展现出了巨大的希望。未来,随着更多临床的开展,干细胞有望给银屑病带来更加有效的治疗选择。
1.Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med. 2009;361:496-509. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in Crossref: 2034] [Cited by in F6Publishing: 2000] [Article Influence: 133.3] [Reference Citation Analysis (0)]
2.Greaves MW, Weinstein GD. Treatment of psoriasis. N Engl J Med. 1995;332:581-588. [PubMed] [DOI] [Cited in This Article: 3] [Cited by in Crossref: 221] [Cited by in F6Publishing: 222] [Article Influence: 7.7] [Reference Citation Analysis (0)]
3. Winterfield LS, Menter A, Gordon K, Gottlieb A. Psoriasis treatment: current and emerging directed therapies. Ann Rheum Dis. 2005;64 Suppl 2:ii87-90; discussion ii91. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in Crossref: 42] [Cited by in F6Publishing: 49] [Article Influence: 2.6] [Reference Citation Analysis (0)]
4. Radi G, Campanati A, Diotallevi F, Bianchelli T, Offidani A. Novel Therapeutic Approaches and Targets for Treatment of Psoriasis. Curr Pharm Biotechnol. 2021;22:7-31. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in Crossref: 18] [Cited by in F6Publishing: 18] [Article Influence: 6.0] [Reference Citation Analysis (0)]
5.Deuse T, Stubbendorff M, Tang-Quan K, Phillips N, Kay MA, Eiermann T, Phan TT, Volk HD, Reichenspurner H, Robbins RC, Schrepfer S. Immunogenicity and immunomodulatory properties of umbilical cord lining mesenchymal stem cells. Cell Transplant. 2011;20:655-667. [PubMed] [DOI] [Cited in This Article: 1] [Cited by in Crossref: 215] [Cited by in F6Publishing: 202] [Article Influence: 14.4] [Reference Citation Analysis (0)]
6. Le Blanc K, Ringdén O. Immunomodulation by mesenchymal stem cells and clinical experience. J Intern Med. 2007;262:509-525. [PubMed] [DOI] [Cited in This Article: 1] [Cited by in Crossref: 530] [Cited by in F6Publishing: 487] [Article Influence: 28.6] [Reference Citation Analysis (0)]
7. Song N, Scholtemeijer M, Shah K. Mesenchymal Stem Cell Immunomodulation: Mechanisms and Therapeutic Potential. Trends Pharmacol Sci. 2020;41:653-664. [PubMed] [DOI] [Cited in This Article: 1] [Cited by in Crossref: 372] [Cited by in F6Publishing: 313] [Article Influence: 78.3] [Reference Citation Analysis (0)]
8. Ahn H, Lee SY, Jung WJ, Lee KH. Alopecia treatment using minimally manipulated human umbilical cord-derived mesenchymal stem cells: Three case reports and review of literature. World J Clin Cases. 2021;9:3741-3751. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in CrossRef: 7] [Cited by in F6Publishing: 11] [Article Influence: 3.7] [Reference Citation Analysis (2)]
9.Owczarczyk-Saczonek A, Krajewska-Włodarczyk M, Kruszewska A, Placek W, Maksymowicz W, Wojtkiewicz J. Stem Cells as Potential Candidates for Psoriasis Cell-Replacement Therapy. Int J Mol Sci. 2017;18. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in Crossref: 12] [Cited by in F6Publishing: 14] [Article Influence: 2.0] [Reference Citation Analysis (0)]
10. Paganelli A, Tarentini E, Benassi L, Kaleci S, Magnoni C. Mesenchymal stem cells for the treatment of psoriasis: a comprehensive review. Clin Exp Dermatol. 2020;45:824-830. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in Crossref: 10] [Cited by in F6Publishing: 10] [Article Influence: 2.5] [Reference Citation Analysis (0)]
11. Chen H, Niu JW, Ning HM, Pan X, Li XB, Li Y, Wang DH, Hu LD, Sheng HX, Xu M, Zhang L, Zhang B. Treatment of Psoriasis with Mesenchymal Stem Cells. Am J Med. 2016;129:e13-e14. [PubMed] [DOI] [Cited in This Article: 3] [Cited by in Crossref: 33] [Cited by in F6Publishing: 33] [Article Influence: 4.1] [Reference Citation Analysis (0)]
12. Wang SG, Hsu NC, Wang SM, Wang FN. Successful Treatment of Plaque Psoriasis with Allogeneic Gingival Mesenchymal Stem Cells: A Case Study. Case Rep Dermatol Med. 2020;2020:4617520. [PubMed] [DOI] [Cited in This Article: 3] [Cited by in Crossref: 7] [Cited by in F6Publishing: 7] [Article Influence: 1.8] [Reference Citation Analysis (0)]
13. Zhao J, Wang J, Dang J, Zhu W, Chen Y, Zhang X, Xie J, Hu B, Huang F, Sun B, Bellanti JA, Zheng SG. A preclinical study-systemic evaluation of safety on mesenchymal stem cells derived from human gingiva tissue. Stem Cell Res Ther. 2019;10:165. [PubMed] [DOI] [Cited in This Article: 3] [Cited by in Crossref: 14] [Cited by in F6Publishing: 15] [Article Influence: 3.0] [Reference Citation Analysis (0)]
14. Bao X, Wang J, Zhou G, Aszodi A, Schönitzer V, Scherthan H, Atkinson MJ, Rosemann M. Extended in vitro culture of primary human mesenchymal stem cells downregulates Brca1-related genes and impairs DNA double-strand break recognition. FEBS Open Bio. 2020;10:1238-1250. [PubMed] [DOI] [Cited in This Article: 3] [Cited by in Crossref: 5] [Cited by in F6Publishing: 7] [Article Influence: 1.8] [Reference Citation Analysis (0)]
15. Liu J, Ding Y, Liu Z, Liang X. Senescence in Mesenchymal Stem Cells: Functional Alterations, Molecular Mechanisms, and Rejuvenation Strategies. Front Cell Dev Biol. 2020;8:258. [PubMed] [DOI] [Cited in This Article: 3] [Cited by in Crossref: 72] [Cited by in F6Publishing: 127] [Article Influence: 31.8] [Reference Citation Analysis (0)]
16. Mattei PL, Corey KC, Kimball AB. Psoriasis Area Severity Index (PASI) and the Dermatology Life Quality Index (DLQI): the correlation between disease severity and psychological burden in patients treated with biological therapies. J Eur Acad Dermatol Venereol. 2014;28:333-337. [PubMed] [DOI] [Cited in This Article: 2] [Cited by in Crossref: 142] [Cited by in F6Publishing: 179] [Article Influence: 16.3] [Reference Citation Analysis (0)]
17. Tong CK, Vellasamy S, Tan BC, Abdullah M, Vidyadaran S, Seow HF, Ramasamy R. Generation of mesenchymal stem cell from human umbilical cord tissue using a combination enzymatic and mechanical disassociation method. Cell Biol Int. 2011;35:221-226. [PubMed] [DOI] [Citedin This Article: 1] [Cited by in Crossref: 66] [Cited by in F6Publishing: 69] [Article Influence: 5.3] [Reference Citation Analysis (0)]
18.Shi Y, Chen Z, Zhao Z, et al. IL-21 induces an imbalance of Th17/Treg cells in moderate-tosevere plaque psoriasis patients [J]. Front Immunol, 2019, 10: 1865.
19. Milosavljevic N, Gazdic M, Simovic Markovic B, et al. Mesenchymal stem cells attenuate liver fibrosis by suppressing Th17 cells - an experimental study [J]. Transpl Int, 2018, 31(1): 102-115.
20. Campanati A, Orciani M, Sorgentoni G, et al. Indirect co-cultures of healthy mesenchymal stem cells restore the physiological phenotypical profile of psoriatic mesenchymal stem cells [J]. Clin Exp Immunol, 2018, 193(2): 234-240.
21. Chang W, Liang N, Cao Y, et al. The effects of human dermal-derived mesenchymal stem cells on the keratinocyte proliferation and apoptosis in psoriasis [J]. Exp Dermatol, 2021, 30(7): 943-950.
22. Rodrigues SC, Cardoso RMS, Freire PC, et al. Immunomodulatory properties of umbilical cord blood-derived small extracellular vesicles and their therapeutic potential for inflammatory skin disorders [J]. Int J Mol Sci, 2021, 22(18): 9797.
23. Zhang W, Lin J, Shi P, et al. Small extracellular vesicles derived from MSCs have immunomodulatory effects to enhance delivery of ASO-210 for psoriasis treatment [J]. Front Cell Dev Biol, 2022, 10: 842813.
24. Meng H, Wei F, Zhou Y, et al. Overexpression of hepatocyte growth factor in dental pulp stem cells ameliorates the severity of psoriasis by reducing inflammatory responses [J]. Stem Cells Dev, 2021, 30(17): 876-889.
25. Zhang Y, Yan J, Li Z, et al. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate psoriasis-like skin inflammation [J]. J Interferon Cytokine Res, 2022, 42(1): 8-18.
26. Zhang B, Lai RC, Sim WK, et al. Topical application of mesenchymal stem cell exosomes alleviates the imiquimod induced psoriasis-like inflammation [J]. Int J Mol Sci, 2021, 22(2): 720.
27.Ahn H, Lee SY, Jung WJ, Pi J, Lee KH. Psoriasis treatment using minimally manipulated umbilical cord-derived mesenchymal stem cells: A case report. World J Clin Cases 2021; 9(23): 6798-6803 [PMID: 34447827 DOI: 10.12998/wjcc.v9.i23.6798]
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
