




引言
根据发表的文献,除了克服大脑衰老外,干细胞外泌体对抗其他器官与衰老相关的疾病具有益处。干细胞外泌体可改善大脑和外周衰老、生殖功能障碍,并抑制细胞衰老,从而逆转一些与衰老相关的疾病和功能障碍。外泌体可以通过多种途径干预衰老的核心机制,比如减少炎症、缓解氧化应激、促进细胞再生等,从而帮助逆转与年龄相关的组织功能衰退。
衰老被定义为随时间生理功能的丧失或下降,增加了死亡的可能性,并与慢性退行性疾病高发相关【1】。随着全球老龄化加剧,衰老相关疾病已成为公共卫生领域的重大挑战。传统疗法多局限于症状管理,无法从根源上逆转衰老进程。
科学家发现,干细胞分泌的细胞外囊泡可携带母细胞的生物活性物质(如蛋白质、miRNA),发挥类似的治疗作用,且具有无细胞、低免疫原性、易穿透血脑屏障等优势,可促进与衰老相关的组织损失和功能的再生,在抗衰老及衰老相关疾病领域具有巨大的应用前景。

根据发表的文献【2】,干细胞外泌体可改善大脑和外周衰老、生殖功能障碍,并抑制细胞衰老,从而逆转一些与衰老相关的疾病和功能障碍。
干细胞外泌体的抗衰老效应 衰老细胞在组织中的积累会损害组织稳态和再生能力,特别是内皮细胞功能受损会降低血管生成【3】。而血管生成作为一种内源性修复机制,在组织再生中起着关键作用,通过恢复血供和向再生部位输送营养物质,影响组织修复。
干细胞外泌体对抗全身衰老的机制
研究表明,干细胞外泌体能增强血管生成,减少内皮细胞衰老,通过富含miR-200a激活Nrf2信号通路对抗衰老【4】。 另外,MALAT1等长链非编码RNA和特定外泌体中的miRNA(如miR-675)可预防衰老相关的心脏功能障碍和血管功能障碍【5】。 干细胞外泌体也被报道可以恢复衰老干细胞的年轻状态,提高其治疗效果【6】,通过多种生物学效应如改善干细胞活性、减少氧化应激和增加血管生成,对抗细胞衰老,以预防多种与衰老相关的疾病。
干细胞外泌体在对抗大脑衰老中的应用
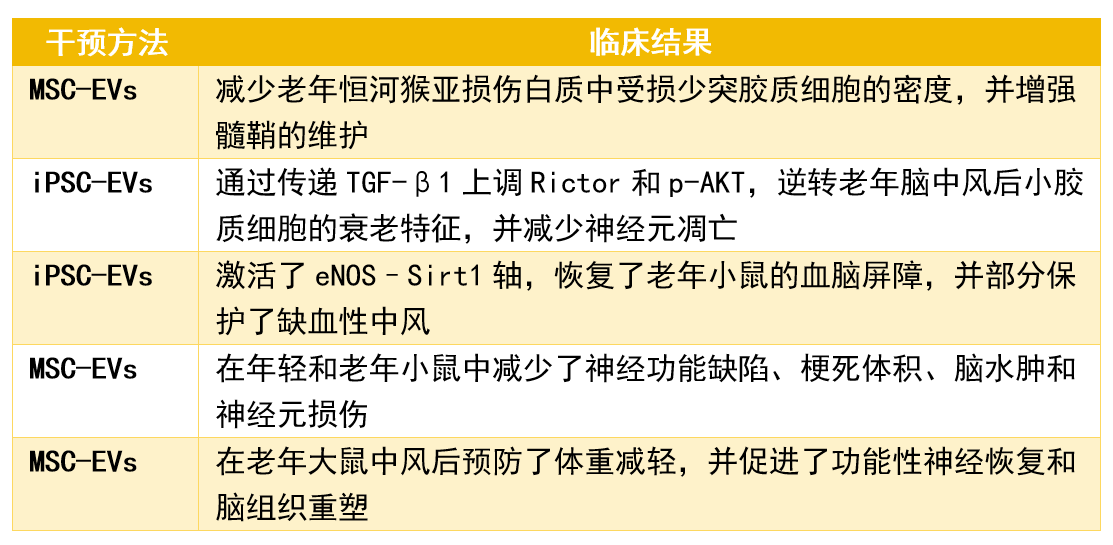
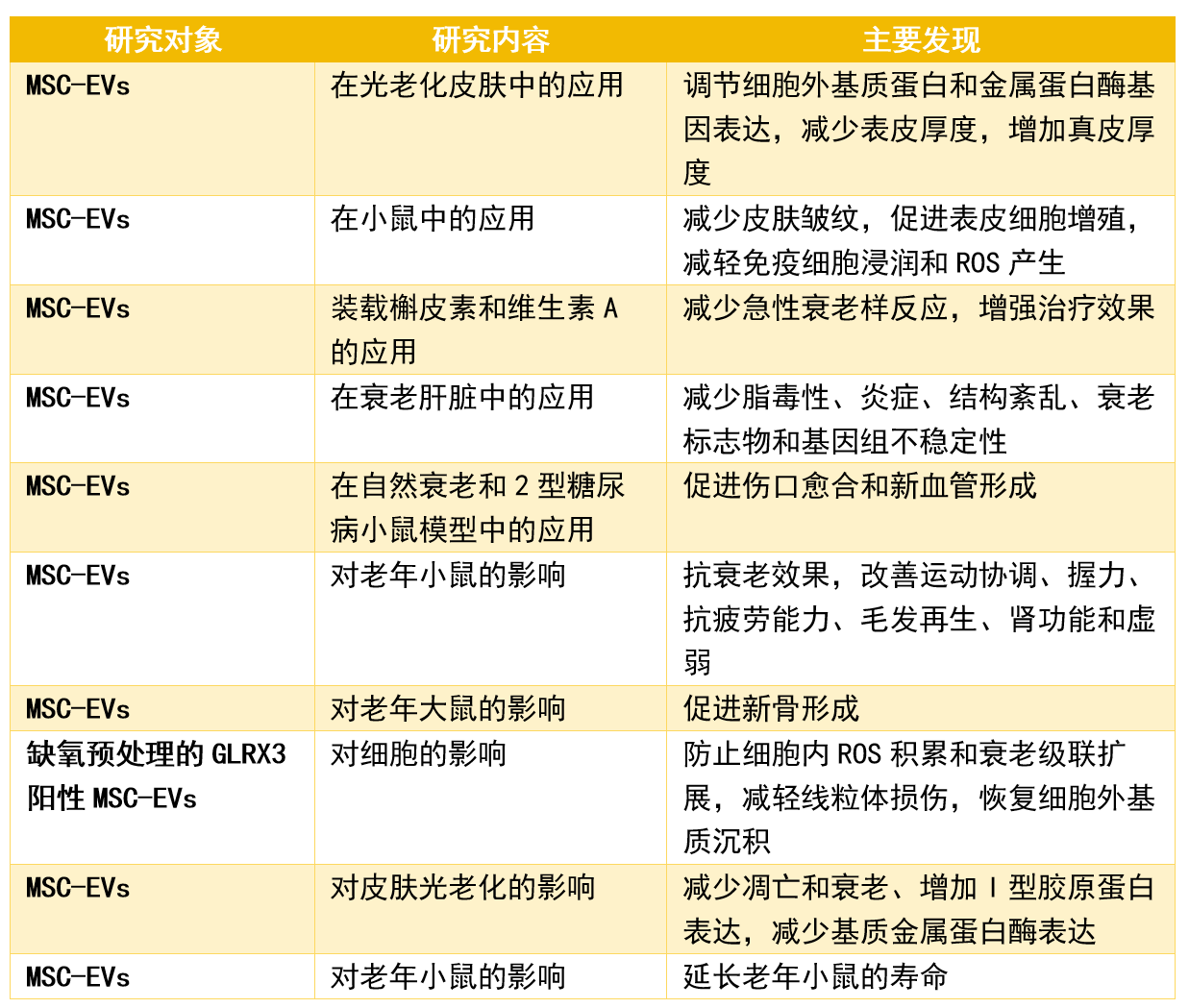
研究表明,干细胞外泌体可以逆转海马神经干细胞的衰老。神经系统在衰老过程中起着关键作用,尤其是下丘脑。神经干细胞在下丘脑中对神经内分泌调节和生理稳态至关重要。 随着衰老,下丘脑干细胞活动减少,导致下丘脑功能减缓,并且下丘脑干细胞分泌的miRNAs与干细胞功能和大脑衰老调节相关。衰老过程中,这些干细胞水平下降,导致miRNAs减少,加速衰老。已有多项研究针对干细胞外泌体抗衰老相关疾病而开展。 以上数据引用自文献2 总体而言,以上研究展示了SC-EVs对抗与年龄相关的脑衰老的神经保护特性。 干细胞外泌体在对抗其他器官衰老中的作用 除了克服大脑衰老外,多项研究表明干细胞外泌体对抗其他器官与衰老相关的疾病具有治疗益处。 以上数据引用自文献2 总体而言,干细胞外泌体在多种外周疾病模型中被证实具有多效性的有益效果。 干细胞外泌体作为年龄相关生殖健康问题的潜在疗法 (1)男性勃起功能障碍 在男性中,勃起功能障碍(erectile dysfunction, ED)与年龄增长有关,尤其在40岁以上男性中更为常见。多项研究显示干细胞衍生的外泌体具有逆转勃起功能障碍的潜力。 例如,2018年一项研究展示了如何使用间充质干细胞(MSC)来源的外泌体通过减轻阴茎海绵体平滑肌细胞的凋亡来恢复大鼠模型中的勃起功能障碍【8】。 同样,其他研究也表明,MSC外泌体治疗可以促进海绵窦内皮形成,减少氧化应激损伤,并改善海绵体中的一氧化氮合酶和平滑肌含量【9】。 此外,还有研究发现,干细胞外泌体可通过减少平滑肌细胞凋亡逆转了勃起功能障碍【10】。 (2)女性卵巢衰老 在女性中,随着年龄的增长,更年期的出现与原始卵泡的耗竭有关,这通常发生在大约50岁左右。卵巢衰老是一个自然的生理过程,它甚至在女性绝经前就开始了。女性的生育能力从30岁初期开始下降,尤其是在35岁之后下降得更为明显。随着年龄的增长,卵巢中的原始卵泡数量和质量都在逐渐减少。 研究显示,间充质干细胞衍生的外泌体在恢复卵巢功能方面是有效的。 (1)间充质干细胞外泌体可以通过调节颗粒细胞的增殖和凋亡来修复小鼠模型中的卵巢损伤【11】。 (2)干细胞外泌体也被证明能够通过特定的分子机制改善卵巢功能【12】。 (3)还有研究发现,将人类子宫内膜间充质干细胞外泌体补充到体外受精的胚胎中,也可以提高胚胎的发育能力和总细胞数【13】。 总之,干细胞外泌体代表了一种新的方法来应对与衰老相关的男性勃起功能障碍和女性卵巢储备减少导致的生育能力下降问题。



小结
干细胞外泌体是一种具有巨大潜力的抗衰老工具。它们是由干细胞释放的微小囊泡,携带多种活性物质,能够调节细胞功能并修复受损组织。研究表明,外泌体可以通过多种途径干预衰老的核心机制,比如减少炎症、缓解氧化应激、促进细胞再生等,从而帮助逆转与年龄相关的组织功能衰退。
不过,要将干细胞外泌体广泛应用于抗衰老治疗,还需要克服一些技术难题。比如,如何大规模生产高质量的外泌体,并确保它们能精准到达目标部位,以及如何设计个性化的方案等等。随着生物工程技术的快速发展,这些问题有望逐步解决。未来,干细胞外泌体可能成为抗衰老医学的核心疗法,为延缓衰老、改善健康提供全新的解决方案。
1.Panagiotou N, Neytchev O, Selman C, Shiels PG, 2018. Extracellular Vesicles, Ageing, and
Therapeutic Interventions. Cells 7(8), 110. [PubMed: 30126173]
2. Hilal Rather,Sameh Almousa,Suzanne Craft, et al. Therapeutic efficacy and promise of stem cell-derived extracellular vesicles in Alzheimer’s disease and other aging-related disorders. Ageing Research Reviews. 2023;92 (0):102088-102088. doi:10.1016/j.arr.2023.102088
3. van Deursen JM, 2014. The role of senescent cells in ageing. Nature 509(7501), 439–446. [PubMed:
24848057]
4. Chen B, Sun Y, Zhang J, Zhu Q, Yang Y, Niu X, Deng Z, Li Q, Wang Y, 2019. Human embryonic
stem cell-derived exosomes promote pressure ulcer healing in aged mice by rejuvenating senescent endothelial cells. Stem Cell Research & Therapy 10(1), 142.
5. Zhu B, Zhang L, Liang C, Liu B, Pan X, Wang Y, Zhang Y, Zhang Y, Xie W, Yan B, Liu F, Yip H-K,
Yu X. y., Li Y, 2019. Stem Cell-Derived Exosomes Prevent Aging-Induced Cardiac Dysfunction through a Novel Exosome/lncRNA MALAT1/NF- κ B/TNF- α Signaling Pathway. Oxidative Medicine and Cellular Longevity 2019, 9739258. [PubMed: 31089420]
6. Zhang Y, Xu J, Liu S, Lim M, Zhao S, Cui K, Zhang K, Wang L, Ji Q, Han Z, Kong D, Li Z, Liu N, 2019. Embryonic stem cell-derived extracellular vesicles enhance the therapeutic effect of mesenchymal stem cells. Theranostics 9(23), 6976–6990. [PubMed: 31660081]
7. Ouyang X, Han X, Chen Z, Fang J, Huang X, Wei H, 2018. MSC-derived exosomes ameliorate erectile dysfunction by alleviation of corpus cavernosum smooth muscle apoptosis in a rat model of cavernous nerve injury. Stem Cell Res Ther 9(1), 246. [PubMed: 30257719]
8. Liu S, Mahairaki V, Bai H, Ding Z, Li J, Witwer KW, Cheng L, 2019. Highly Purified Human Extracellular Vesicles Produced by Stem Cells Alleviate Aging Cellular Phenotypes of Senescent Human Cells. STEM CELLS 37(6), 779–790. [PubMed: 30811771]
9. Liang L, Zheng D, Lu C, Xi Q, Bao H, Li W, Gu Y, Mao Y, Xu B, Gu X, 2021. Exosomes erived from miR-301a-3p-overexpressing adipose-derived mesenchymal stem cells reverse hypoxia-induced erectile dysfunction in rat models. Stem Cell Res Ther 12(1), 87. [PubMed: 33494812]
10.Huang B, Lu J, Ding C, Zou Q, Wang W, Li H, 2018. Exosomes derived from human adipose mesenchymal stem cells improve ovary function of premature ovarian insufficiency by targeting SMAD. Stem Cell Res Ther 9(1), 216. [PubMed: 30092819]
11.Yang Y, Zhou J, Li J, 2020. Regulation of exosome for Alzheimer’s disease derived from mesenchymal stem cells. Zhong Nan Da Xue Xue Bao Yi Xue Ban 45(2), 169–175. [PubMed: 32386043]
12.Marinaro F, Macias-Garcia B, Sanchez-Margallo FM, Blazquez R, Alvarez V, Matilla E, Hernandez N, Gomez-Serrano M, Jorge I, Vazquez J, Gonzalez-Fernandez L, Pericuesta E, Gutierrez-Adan A, Casado JG, 2019. Extracellular vesicles derived from endometrial human mesenchymal stem cells enhance embryo yield and quality in an aged murine modeldagger. Biol Reprod 100(5), 1180–1192. [PubMed: 30596891]
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
