




引言
所有的细胞都可以分泌外泌体,但不同细胞可分泌不同的外泌体。研究发现,间充质干细胞分泌外泌体的能力最强。而间充质干细胞来源广泛,可从脐带、胎盘、脂肪及骨髓等组织中分离,并且不同来源间充质干细胞存在着异质性,这也决定着不同来源的间充质干细胞所分泌的外泌体也有差异。根据最新发表的文献,不同来源的间充质干细胞在蛋白质分泌上存在显著差异,来自胎盘和脐带的MSCs因分泌组的多样性被认为具有更大的治疗潜力,因为它们能够提供更广泛的生物活性分子来促进组织修复。
近年来,外泌体吸引了众多科研人员与医疗从业者的目光。从疾病诊断到治疗,外泌体都展现出了巨大的潜力,在肿瘤研究、神经科学以及再生医学等多个领域都有着积极的探索。
然而,必须明确的是,外泌体并非千篇一律。外泌体是一种细胞外囊泡,携带的物质包括微小RNA、蛋白质、脂质等,它作为信息载体参加细胞间通讯。
所有的细胞都可以分泌外泌体,但不同细胞可分泌不同的外泌体。
研究发现,不同细胞来源的外泌体所携带的内容物也不尽相同。不同来源的外泌体在功能、特性以及应用价值上存在着显著的差异。
随着研究的深入,越来越多的文献揭示了外泌体来源对其功能和应用效果的深刻影响。这就提醒着科研人员在开展外泌体相关研究与应用时,不能忽视其细胞来源这一关键因素。
只有深入理解不同来源外泌体的特性,才能更好地挖掘外泌体的潜力,推动其在生物医学领域的进一步发展,为攻克诸多疑难病症带来新的希望与契机。
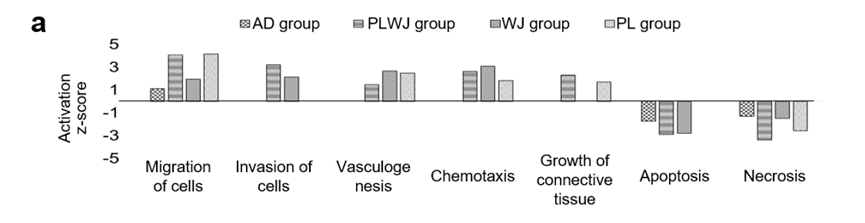
间充质干细胞:分泌外泌体的能力最强 在现代医学中,干细胞被认为是一种革命性的治疗方法,它们拥有修复受损组织并促进组织再生的能力。其中,间充质干细胞(MSCs)因其独特的免疫调节和旁分泌特性而备受关注。这些细胞不仅能够分化成多种细胞类型,还能分泌一系列生物活性分子,帮助调节炎症反应、促进血管生成和抑制细胞死亡。 研究发现,间充质干细胞分泌外泌体的能力最强[4-7],间充质干细胞来源外泌体具备间充质干细胞相似的组织损伤修复和再生功能,因此也是前临床应用最为广泛的外泌体。 间充质干细胞来源外泌体具有显著的特点,比如易储存、易获取且效果好,并且具有调控免疫细胞和影响炎性因子等作用,因此成为了极具潜力的临床研究方向。 图片来自文献[1] 研究发现[1],间充质干细胞来源外泌体具有多种生物作用,包括: 当前,间充质干细胞来源外泌体在自身免疫性疾病、移植物抗宿主反应以及损伤修复、美容抗衰等等方向具有极大的应用价值。 不同MSC来源外泌体的比较: 脐带和胎盘间充质干细胞外泌体具有更大潜力 间充质干细胞来源广泛,脐带、胎盘、脂肪及骨髓等组织中均能分离出间充质干细胞。然而,不同组织来源的间充质干细胞具有异质性,因此所分泌的外泌体也有所差异。 日前,International Journal of Molecular Sciences杂志上的文章对脂肪、骨髓、胎盘和脐带中的MSCs分泌组进行了深入的比较分析。 图1. 不同来源的间充质干细胞具有不同的分泌特征[2]。使用条件培养基、质谱分析和生物信息学分析了脂肪(AD)、骨髓(BM)、胎盘(PL)和华纳氏胶(WJ)来源的人间充质干细胞的蛋白质分泌组。根据来源的不同,每种间充质干细胞的分泌组都具有不同的特征。 不同来源的MSCs通过其分泌的蛋白质发挥治疗作用。研究通过质谱分析技术比较了这些细胞的蛋白质分泌组,揭示了它们在治疗潜力上的差异。 (1)分泌差异 通过质谱分析,研究人员发现不同来源的MSCs在蛋白质分泌上存在显著差异(图2)。这些差异不仅体现在蛋白质的种类上,还体现在蛋白质的丰度和功能上。例如,胎盘和脐带来源的MSCs显示出更多样化的蛋白质分泌,这可能与它们的高再生潜力有关。 (2)功能相似 尽管不同来源的MSCs在蛋白质组成上存在差异,但它们在促进细胞迁移、抑制细胞死亡等关键生物学功能上具有相似性(图2)。这些功能对于组织修复和再生至关重要。 来自胎盘和脐带的MSCs因分泌组的多样性被认为具有更大的治疗潜力,因为它们能够提供更广泛的生物活性分子来促进组织修复。 图2. 不同来源的间充质干细胞分泌蛋白组的功能表征[2]。(a) 不同组特异性蛋白的生物学功能预测(p < 0.01)。 在临床中,也有研究者对不同来源间充质干细胞外泌体的疗效进行了比较。例如有研究比较了脐带间充质干细胞来源外泌体以及骨髓间充质干细胞来源外泌体在骨关节炎治疗疗效上的差异,结果显示[3],在产量和纯度上,脐带间充质干细胞来源外泌体均高于骨髓间充质干细胞来源外泌体;两种外泌体均能缓解白细胞介素1β对软骨细胞的炎症作用,主要表现在促进增殖,抑制凋亡和增加细胞外基质的分泌,其中脐带间充质干细胞来源外泌体的促软骨修复活性更强。 参考文献: [1]郭嘉,丁琼桦,刘泽,等.间充质干细胞来源外泌体的生物学特性及免疫调控作用[J].中国组织工程研究, 2022, 26(7):9. [2]Shin S, Lee J, Kwon Y, Park K-S, Jeong J-H, Choi S-J, Bang SI, Chang JW, Lee C. Comparative Proteomic Analysis of the Mesenchymal Stem Cells Secretome from Adipose, Bone Marrow, Placenta and Wharton’s Jelly. International Journal of Molecular Sciences. 2021; 22(2):845. https://doi.org/10.3390/ijms22020845 [3] 王宪峰,欧昕,邓必勇.不同来源间充质干细胞外泌体治疗骨关节炎疗效的比较[J].中国组织工程研究, 2022, 26(25):6. [4] HARDING C, HEUSER J, STAHL P. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. J Cell Biol. 1983;97(2):329-339. [5] PAN BT, TENG K, WU C, et al. Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. J Cell Biol. 1985;101(3):942-948. [6] 缪着 , 卢福琼 , 马波 , 等 . 人间充质干细胞外泌体研究进展 [J]. 中国医药生物 技术 ,2019,14(4):361-365. [7] LAI RC, ARSLAN F, LEE MM, et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res. 2010;4(3):214-222.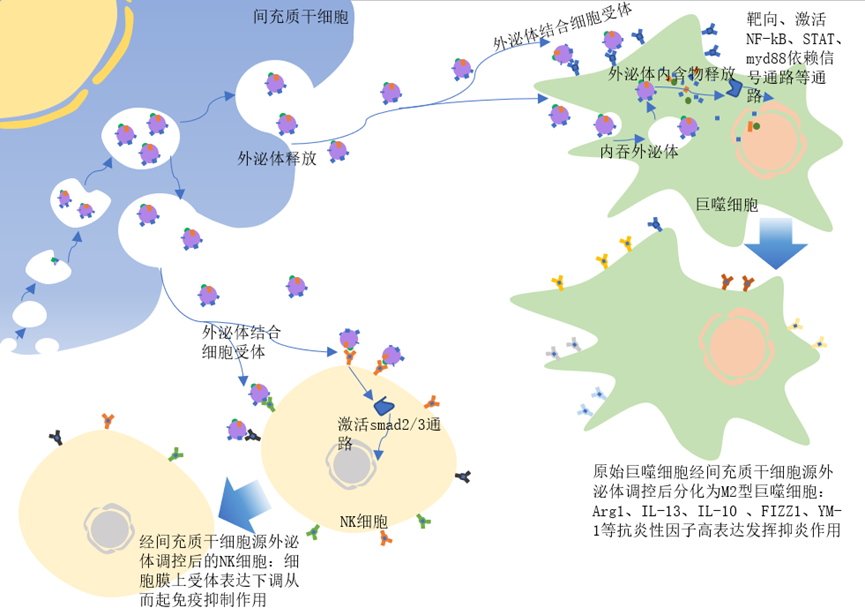
间充质干细胞外泌体具多种作用
(1)间充质干细胞来源外泌体具有与其母源细胞相同的免疫调控功能,例如携带免疫抑制因子、影响巨噬细胞向M2型极化、调节T细胞的分化及抗原提呈等作用。
(2)间充质干细胞外泌体可抑制炎症的发展,减少并发症的发生;
(3)间充质干细胞外泌体还可通过再生作用促进损伤器官的修复,进而有利于患者康复。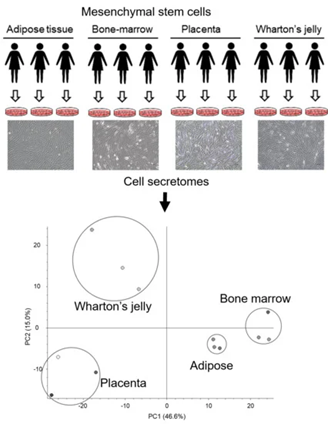
小结
间充质干细胞外泌体作为新兴的生物活性分子载体,在临床应用上展现出巨大的潜力。这些微小囊泡能够传递干细胞的关键功能特性,为疾病治疗和人体康复提供新途径。
然而,外泌体的质量与干细胞来源及制备工艺紧密相连,确保来源的可靠性和符合GMP标准的制备工艺至关重要。
当前,科学家们正积极探索外泌体的功能,不断深化对外泌体的具体作用机制的理解。但外泌体含量少且提取流程复杂,成为制约其临床转化的瓶颈。
因此,未来需加大科研力度,优化提取技术,开展更大规模的临床研究,以充分挖掘间充质干细胞外泌体的治疗潜力,推动其在医学领域的广泛应用。
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
