




引言
近年来,干细胞外泌体鼻喷、雾化、静脉回输等成为了临床上常见的方式,不同的给药方式则针对不同的临床场景。本文通过汇总文献,比较了鼻喷、雾化、静脉、局部注射等不同的给药方式的特点,以及汇总在不同的给药方式下干细胞外泌体所能够解决的临床问题。
近年来,干细胞外泌体成为了医学的新焦点,它的几种应用方式——雾化、静脉回输、鼻滴/经鼻给药等,更是吸引了大家的广泛关注。
外泌体,作为细胞间通讯的关键媒介,能够携带各种生物分子,如蛋白质、脂质和核酸,穿梭于细胞之间,传递重要的信号和信息。而雾化、静脉回输或者鼻滴等不同的给药方式,跟外泌体进入体内后的生物分布以及效果有密切的关系。
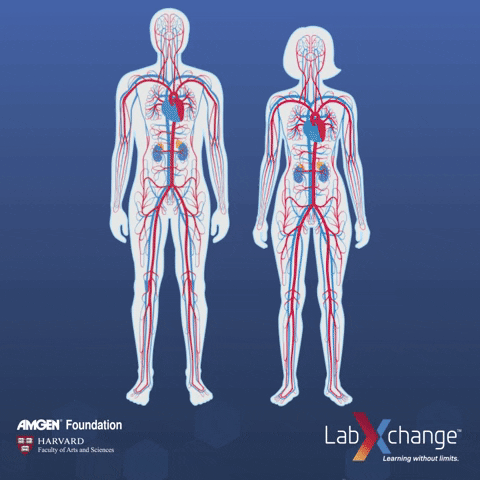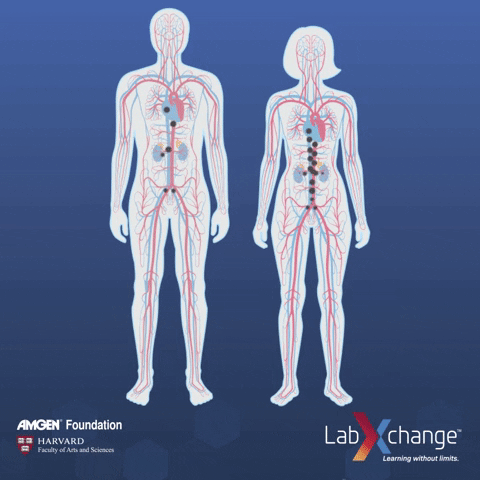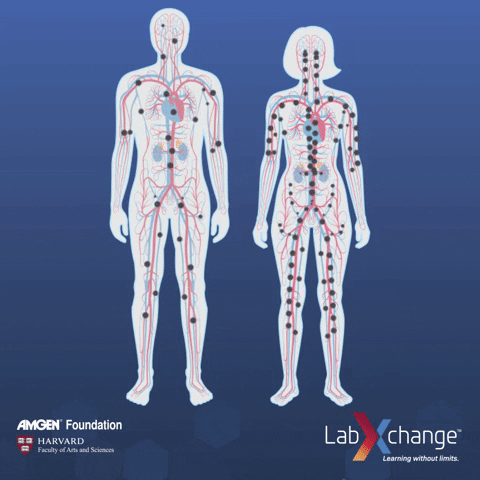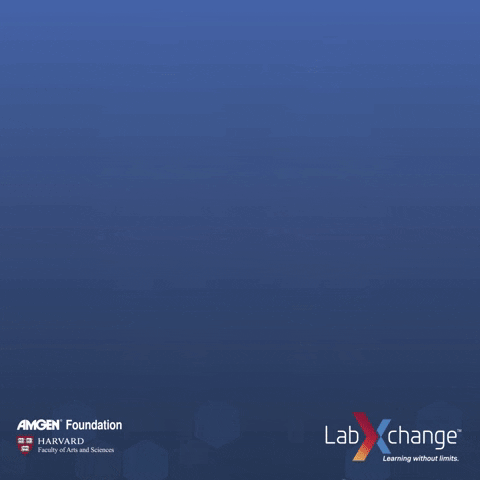
外泌体在身体里的分布,就是指它们在体内通过血液循环或淋巴系统分布的方式。这对药物送达目的地和准确找到目标非常重要。如果我们能更清楚地了解这一点,就能更好地设计药物、提高治病效果,同时还能减少可能带来的副作用。
今天我们就来科普,雾化、静脉、鼻喷等不同的干细胞外泌体给药方式各自有怎样的特点,以及各自在临床上的使用场景。
干细胞外泌体鼻喷、雾化、静脉等不同给药方式的特点
事实上已有多项研究针对外泌体生物分布而开展,例如有团队对比气管内(IT)、鼻内(IN)和静脉注射(IV)外泌体在小鼠模型中的生物分布[1]。

研究发现,静脉注射后外泌体在脾脏和肝脏中的积累。
干细胞外泌体气管内给药后 24 小时,在离体肺中选择性地检测到更强的阳性,而对于鼻内给药,信号局限于大脑。
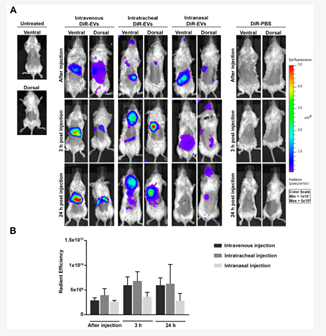
图片引用自文献1
通过仔细查阅文献,我们发现外泌体给药途径并不局限于以上几种,然而不同给药方式下却显示出差异。
静脉给药:在众多给药途径中,静脉注射是最为常见的方法。外泌体通过血液循环迅速分布至全身,但其在血液中的稳定性及靶向性问题,限制了其在目标部位的浓度,影响了治疗效果[2]。

局部注射:局部注射则是一种更为精确的给药方式,它允许外泌体直接作用于病变部位。尽管这种方法提高了局部治疗效果,但其操作复杂性及对病变部位精确定位的要求,限制了其应用范围。
鼻腔给药:鼻腔给药是一种非侵入性的给药途径,它允许外泌体通过鼻腔黏膜吸收,进入血液循环或直接作用于中枢神经系统。然而,鼻腔黏膜的屏障作用限制了外泌体的生物利用度[3]。
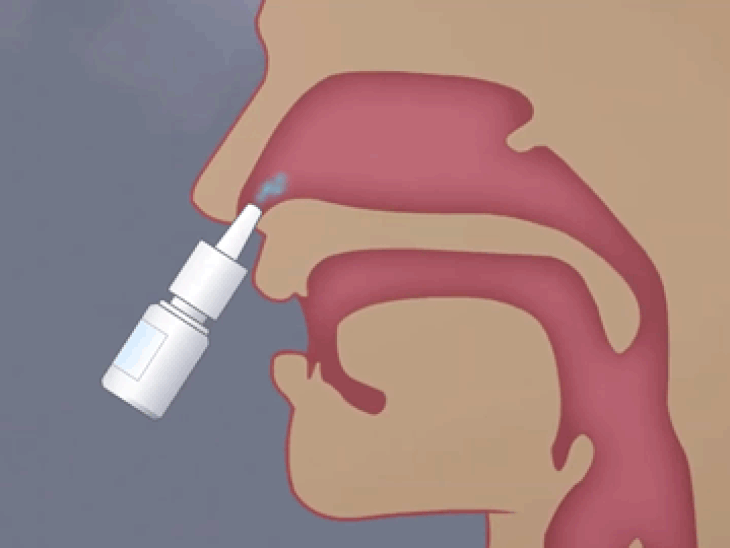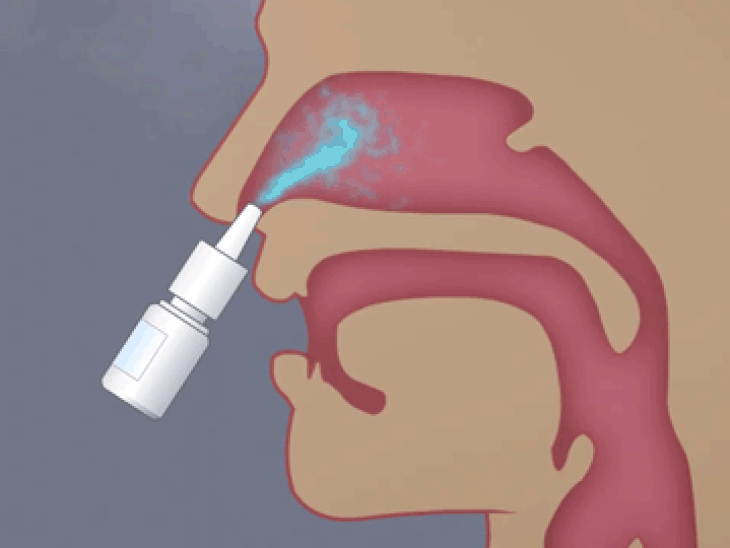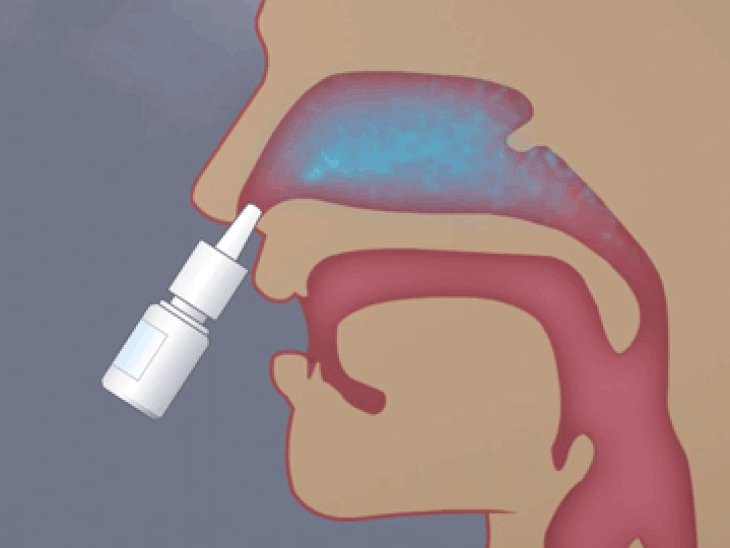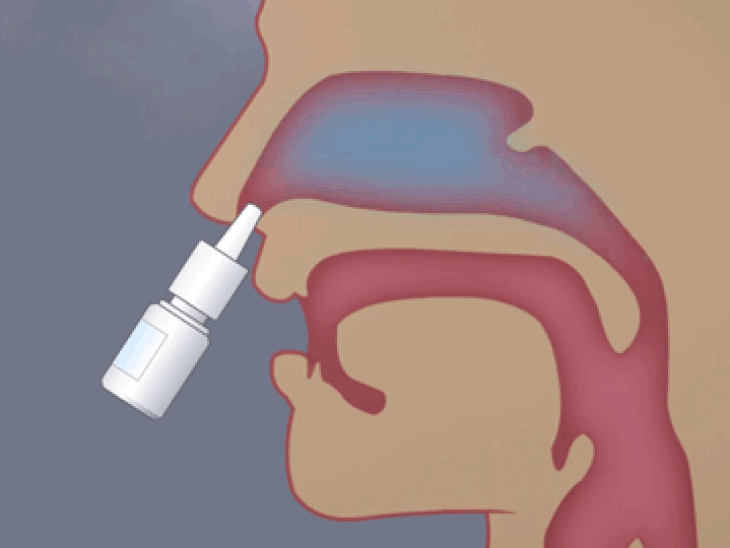
鼻粘膜上皮层是鼻内给药过程中药物渗透的第一道屏障,酶促降解又是另一重限制,特别是对于蛋白质和肽类药物,它们可以在穿过上皮屏障时被腔中存在的酶降解,从而降低生物利用度。
气管给药:气管内给药递送的外泌体已被证明可以在肺部有效积聚,与静脉内给药相比,其浓度显著提高,而这种选择性分布只强调了治疗肺部疾病的潜力[4]。
图片来自海洛站酷
由此,我们可以归结为以下这些信息:
不同给药途径外泌体的生物分布

干细胞外泌体不同给药方式针对的临床场景
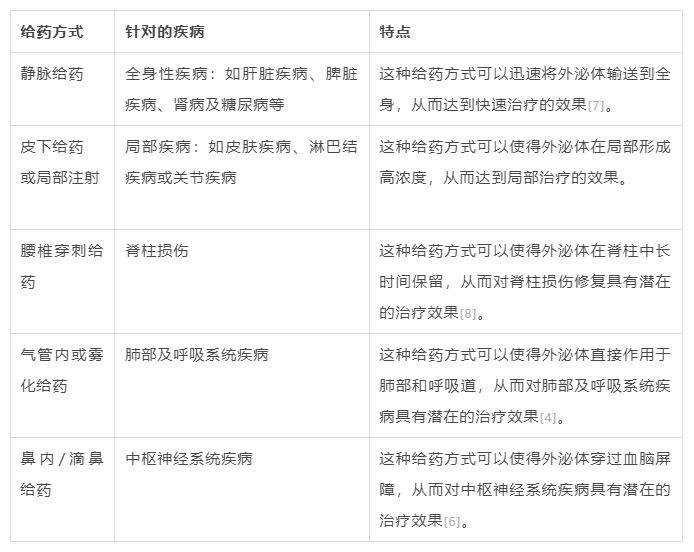
近年来,越来越多的临床研究讲干细胞外泌体应用到了疾病的治疗研究中,并且针对不同类型的临床疾病,选择的给药方式也有差异。
干细胞外泌体临床应用与挑战
外泌体作为一种新的医学焦点,在临床应用中的潜力巨大。但要实现这一潜力,必须深入理解其在体内的生物分布特性,并据此选择最合适的给药方式。这不仅需要跨学科的合作,还需要对药物动力学和药效学有深入的了解。

尽管研究已经揭示了外泌体在体内的生物分布特性,但如何精确控制其分布仍然是一个难题。目前,研究人员正在探索通过修饰外泌体的表面特性或装载特定的分子来调节其生物分布。这些努力有望为个性化治疗提供新的策略。
此外,外泌体的制备和纯化技术也是影响其应用的关键因素。要确保外泌体的质量和安全性,必须建立严格的生产标准和质量控制体系。这不仅包括对外泌体的纯度、活性和稳定性的评估,还需要对其潜在的毒性和免疫原性进行深入研究。

同时,我们还需要关注外泌体在体内的长期效应。虽然短期内的生物分布和疗效已经得到了广泛研究,但长期内外泌体在体内的变化和对机体的影响仍然知之甚少。为了全面评估外泌体的安全性和有效性,我们需要进行长期跟踪研究,并密切关注可能出现的副作用和并发症。
尽管面临诸多挑战,但外泌体的应用前景仍然广阔。随着研究的不断深入和技术的不断进步,我们有望克服这些挑战,并开发出更加安全、有效和个性化的治疗方法。这将为患者带来更好的治疗效果和生活质量,同时也将推动医学科学的进步和发展。
小结
近年来,干细胞外泌体的应用研究领域不断拓展,干细胞外泌体雾化、鼻喷、静脉回输等创新方案为医学与健康领域带来了更多的可能性。未来,仍需开展更多的研究,针对患者的具体需求,开发更加个性化的干预方案,实现治疗效果的最大化。同时,仍需更加深入的理解干细胞外泌体在体内的生物分布特性,进一步探索不同给药方式的疗效和安全性,以及如何优化外泌体的制备和修饰,从而提高其在临床中的应用潜力,使之能够在医学上发挥更大的作用。
参考文献:
1.Tolomeo, A.M.; Zuccolotto, G.; Malvicini, R.; De Lazzari, G.; Penna, A.; Franco, C.; Caicci, F.; Magarotto, F.; Quarta, S.; Pozzobon, M.; et al. Biodistribution of Intratracheal, Intranasal, and Intravenous Injections of Human Mesenchymal Stromal Cell-Derived Extracellular Vesicles in a Mouse Model for Drug Delivery Studies. Pharmaceutics 2023, 15, 548. https://doi.org/10.3390/pharmaceutics15020548
2.Smyth T,Kullberg M,Malik N, et al. Biodistribution and delivery efficiency of unmodified tumor-derived exosomes. J Control Release. 2015;199:145-55. doi:10.1016/j.jconrel.2014.12.013
3.Rinaldi F,Oliva A,Sabatino M, et al. Antimicrobial Essential Oil Formulation: Chitosan Coated Nanoemulsions for Nose to Brain Delivery. Pharmaceutics. 2020;12 (7):null. doi:10.3390/pharmaceutics12070678
4.Saito E,Gurczynski SJ,Kramer KR, et al. Modulating lung immune cells by pulmonary delivery of antigen-specific nanoparticles to treat autoimmune disease. Sci Adv. 2020;6 (42):. doi:10.1126/sciadv.abc9317
5.In vivo tracking of [89Zr]Zr-labeled engineered extracellular vesicles by PET reveals organ-specific biodistribution based upon the route of administration. Nuclear Medicine and Biology, 112-113 (2022) 20–30.
6.Gu Z,Yin Z,Song P, et al. Safety and biodistribution of exosomes derived from human induced pluripotent stem cells. Front Bioeng Biotechnol. 2022;10:949724. doi:10.3389/fbioe.2022.949724
7.Wang S, Lei B, Zhang E, Gong P, Gu J, He L, Han L, Yuan Z. Targeted Therapy for Inflammatory Diseases with Mesenchymal Stem Cells and Their Derived Exosomes: From Basic to Clinics. Int J Nanomedicine. 2022 Apr 19;17:1757-1781. doi: 10.2147/IJN.S355366. PMID: 35469174; PMCID: PMC9034888.
8.Goutman SA, Chen KS, Feldman EL. Recent Advances and the Future of Stem Cell Therapies in Amyotrophic Lateral Sclerosis. Neurotherapeutics. 2015 Apr;12(2):428-48. doi: 10.1007/s13311-015-0339-9. PMID: 25776222; PMCID: PMC4404436
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
