




引言
近年来,间充质干细胞被广泛应用于不同人群中,在大量的临床数据中,我们能够看到间充质干细胞疗法的效果存在显著的个体差异,这除了跟患者的健康状况和疾病状态有关以外,更可能会受到间充质干细胞的给药途径、剂量、制备方法、细胞质量等等因素的影响。本文通过剖析10篇文献,从治疗方案、间充质干细胞的制备以及间充质干细胞的质量三个维度,带大家了解为何不同的人用间充质干细胞后效果不太一样。
间充质干细胞(MSCs),凭借其自我更新能力及多向分化潜能,已成为再生医学领域内炙手可热的研究焦点。这些干细胞不仅能够转化为多样化的细胞类型,还展现出强大的免疫调节特性[1],为治疗一系列疾病开辟了新途径,提供了新的临床治疗选择方案。

图片来自参考文献1)
MSCs因其低免疫原性和强大的免疫调节能力,能够在很大程度上跨越主要组织相容性障碍的局限,实现相对无碍的移植过程[2],因此被广泛应用到不同人群的治疗研究中。
然而,在临床实践中,针对各类疾病实施的干细胞疗法,其疗效在患者间展现出显著的差异性,这除了跟患者的健康状况和疾病状态有关以外,还可能会受到MSCs的给药途径、剂量、制备方法、细胞质量等等因素的影响。本文通过剖析文献,从治疗方案、间充质干细胞的制备以及间充质干细胞的质量三个维度,带大家了解为何不同的人用间充质干细胞后效果不太一样。
治疗方案的影响:
适应症、给药途径、剂量等都会导致效果的差异
在临床中,不同的治疗方案,如适应症的不同、药物选择、治疗频率、疗程长短等,都可能产生不同的结果。同样,干细胞治疗的结果也会与干细胞的给药方式、给药剂量以及针对的适应症等因素息息相关。
根据文献统计[9],干细胞给药方式可大致分为三类:
常见的三类干细胞给药方式
第一类是全身给药——静脉或者动脉给药,比较多应用于治疗神经衰弱,阿尔兹海默病,系统性红斑狼疮等全身系统性疾病中;
第二类是应用的较为广泛的局部区域递送给药——皮下注射,肌肉注射以及鞘内注射等等,常见于骨科、妇产科、胃肠系统等相关疾病;
第三类是将干细胞附着在生物材料上,利用生物支架/生物工程构建体进行给药,常常见于再生医学领域中。
干细胞的不同给药方式,如静脉注射、局部注射(如关节内注射、脊髓鞘内注射等),会因其进入体内的路径和分布不同,导致治疗效果产生显著差异。
有研究表示[3],针对MSCs的旁分泌作用——分泌包括细胞外囊泡和细胞因子以及免疫应答修饰等等,与全身用药比较而言, MSCs以靶向局部注射的给药方式注射到机体病灶区可以有效的增加MSCs的旁分泌活性,使其分泌保护性旁分泌因子,从而延长/增强干细胞疗法的治疗潜力。
此外,注射部位的选择、注射器的特征(如尺寸和形状)、载体材料和缓冲液的配方等因素可能对细胞给药效果产生影响。
由此可见,根据不同的适应症来选择适合的给药方式,能更精准地引导干细胞到达病灶,从而提高疗效。
除了给药途径,干细胞的注射剂量也对疗效产生影响。在临床实践中,细胞剂量与疾病的程度、疾病的类型以及给药方式等等因素有关。
目前而言,MSC 在治疗应用中的最佳剂量并不统一,并且取决于治疗类型,但更多研究通常会使用每公斤体重 1.0–2.0 × 10 6 MSC做为其理想剂量,Chiho等人统计目前最新的47项MSCs的临床研究,仍以每公斤体重 1.0–2.0 × 10 6 MSC为主[4],具体内容可见下图。
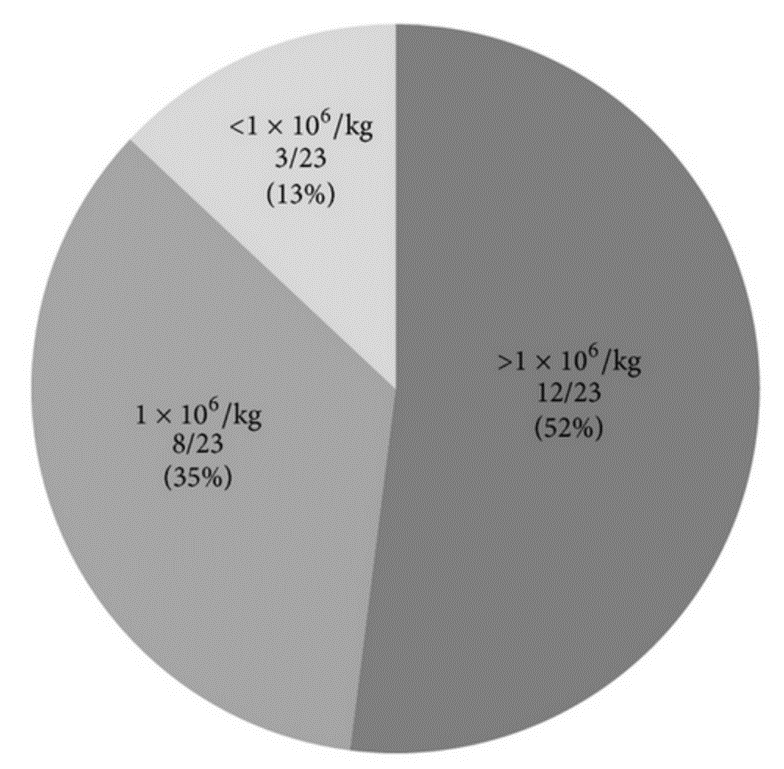
(图片来自参考文献3)
从临床试验中可以看出,关于不同剂量的间充质干细胞的临床效果目前仍然是临床研究的重点探讨方向。
间充质干细胞制备的影响:
生产环境不同,结果也会有差异
除了给药途径和给药剂量的不同会影响到干细胞疗法的疗效之外,MSCs不同的制备方法也很有可能会影响到治疗的效果。根据文献[4],全球有一些间充质干细胞临床试验已经完成,还有许多正在进行中,临床试验证实了这种方法的可行性和安全性。然而,这些试验中间充质干细胞的分离和扩增方案差异很大,这可能会影响治疗的效果。
例如培养干细胞的烧瓶、培养基、扩增剂,干细胞的接种密度、传代以及储存条件等等方面都是不尽相同的。以接种密度为例,细胞接种密度是影响MSC 产量效率的一大重要因素,因为这会影响 MSC 的粘附、其他细胞类型的污染以及贴壁MSC的后续生长速度。这些因素也影响到最终间充干细胞制剂的质量,并影响到最终的使用效果。
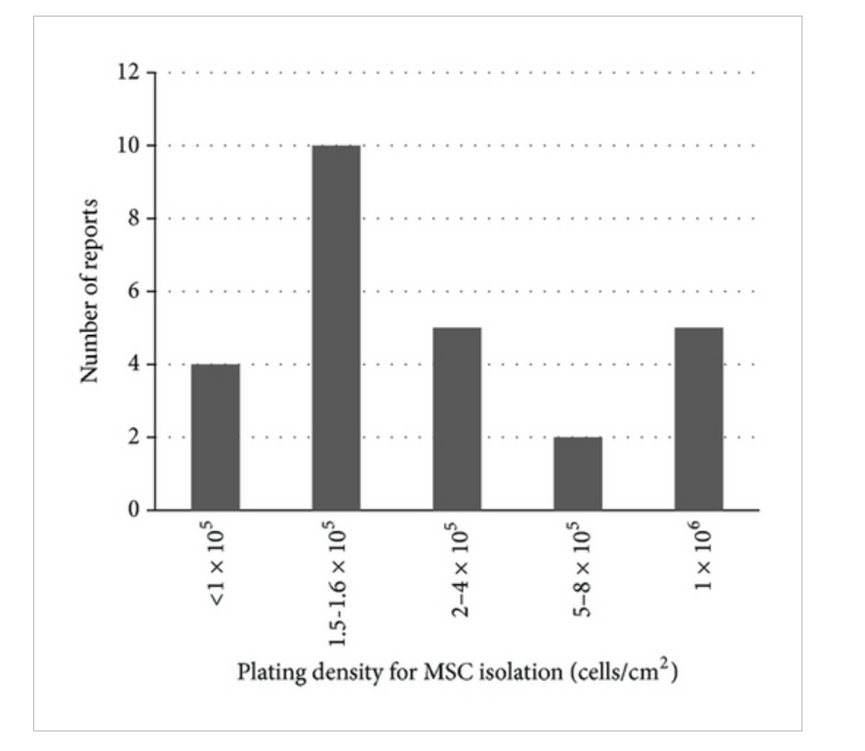
(图片来自参考文献4)
在未来,干细胞疗法可能会成为医学领域的主流,但目前只有一些中心能够生产和供应符合临床级要求的干细胞制剂。
还有文献强调[5],在GMP 条件下生产出的干细胞产品并进行有效监管,可以有效提高干细胞疗法的治疗效率。
下图总结了GMP工艺下MSC 制造的主要步骤。

图片来自文献5
间充质干细胞质量的影响:
年龄、来源以及异质性等
除了上述的两大因素外,近期,发布在“Cells”上面的一篇“Universal or Personalized Mesenchymal Stem Cell Therapies: Impact of Age, Sex, and Biological Source”新综述还阐述了间充质干细胞的质量——包括间充质干细胞供者的年龄、来源、不同性别间充质干细胞的差异,也可以对干细胞疗法疗效产生影响[6]。

(图片来自参考文献6)
(1)年龄不同,间充质干细胞的功能会有差异
对于干细胞疗法的疗效而言,毋庸置疑,个体年龄是影响MSCs功能的最重要因素之一。研究表明,如下图所示,随着年龄的增加,MSCs的增殖和分化能力显著下降。这一现象不仅在体外培养的MSCs中得到了验证,而且在动物实验和临床研究中也得到了证实[7]。
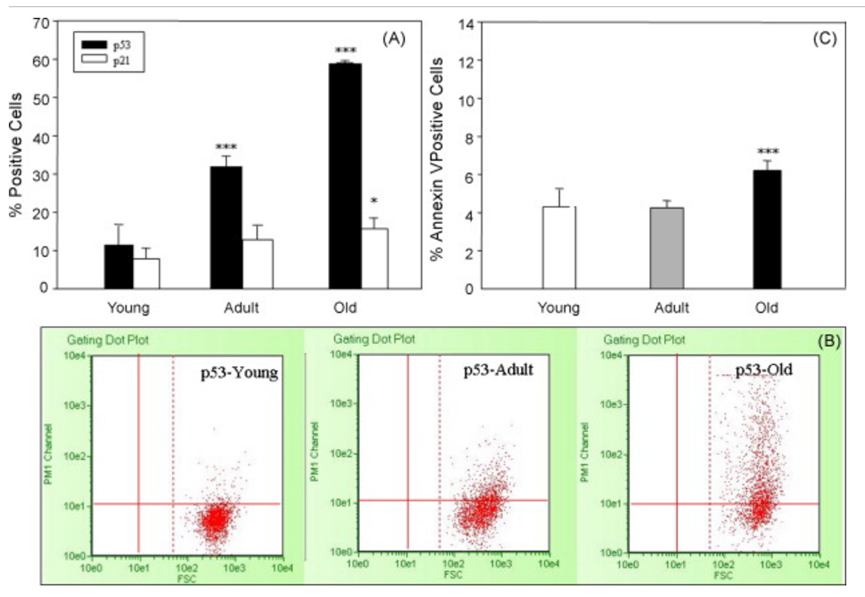
(图片来自参考文献7)
从以上的研究结果我们不难看出老年人的MSCs表现出增殖能力下降、分化潜力减弱以及形态学上的变化。例如,老年MSCs在体外培养时更容易出现细胞老化现象,表现为细胞体积增大、形态改变以及β-半乳糖苷酶活性增加等。此外,老年MSCs在抗氧化应激方面的能力也显著降低,导致细胞更容易受到损伤并加速老化。
(2)性别不同,间充质干细胞的功能也有差异
除了年龄之外,性别也是影响MSCs功能的另一大重要因素。研究表明,男性和女性在免疫反应和MSCs的生物学特性方面存在显著差异。Stefano等人研究发现,捐赠者的性别对MSCs的增殖和分化能力也有影响[8],主要实验结果见下图。
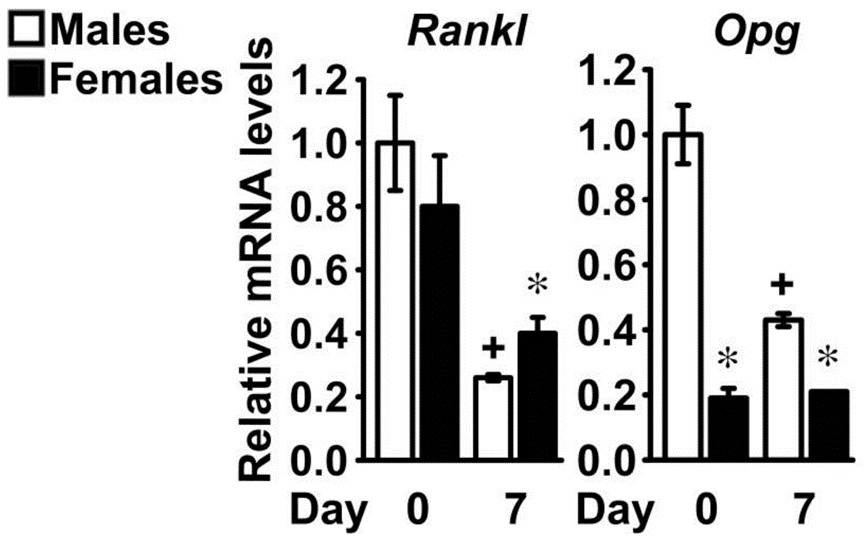
(图片来自参考文献8)
由以上实验结果我们可以看出来自男性的成骨细胞中Rankl和Opg基因的表达较高,这增加了MSCs分化为成骨细胞的能力。此外,女性中,脂肪来源的MSCs产生的IL-6数量更多,这表明不同性别的MSCs在细胞因子分泌方面也存在差异。
(3)细胞来源不同,间充质干细胞的效果也不同
除了年龄、性别这两大因素之外,MSCs的来源也可以影响到其治疗疗效。MSCs可以从多种组织来源中获取,包括骨髓、脂肪组织和脐带/胎盘等,而不同来源的MSCs在生物学特性和治疗效果方面可能存在差异,因此,针对不同的适应症选择合适的组织来源的间充质干细胞对最终的临床结果至关重要。
骨髓来源间充质干细胞
骨髓来源的MSCs是最早被发现并广泛研究的一种MSCs。这些细胞具有较强的成骨和成软骨分化能力,适用于治疗骨关节炎等疾病。然而,获取BM-MSCs需要进行侵入性手术,对患者造成一定的痛苦。
脂肪来源间充质干细胞
来自脂肪组织(ASCs)的间充质干细胞是从涉及到吸脂或脂肪切除术的医疗干预措施后获得的组织样本中分离出来的。患者通过抽吸或切除位于腹部、肱部、股骨或臀部区域的脂肪组织或皮下脂肪组织的方法获取脂肪组织,之后再用胶原酶消化脂肪组织,然后通过特异性红细胞裂解去除红细胞,最后进行细胞过滤等操作获得。
脂肪干细胞分泌促进血管化的血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、成纤维细胞生长因子(FGF2)、转化生长因子(TGFβ)等, 促进血管新生和创伤愈合,在组织创伤修复与再生中发挥重要作用;在脂肪移植、皮瓣移植、创面愈合、瘢痕修复、毛发再生及抗衰老等整形修复领域中被广泛应用研究。
脐带/胎盘来源间充质干细胞
脐带来源的MSCs不受供体年龄和健康状况的限制,且具有较强的分化能力和免疫调节功能。脐带来源的间充质干细胞除了具有较为常见的造血支持功能外,还具有成骨、脂肪形成、神经、软骨和心肌分化作用。

研究发现,脐带来源间充质干细胞的成脂能力强于其他来源间充质干细胞。因此,在脂肪填充、脱发、肝衰竭等需要脂肪细胞的疾病领域更具有优势。研究还发现,使用脐带干细胞还可以对缺血性肢体疾病和血管闭塞疾病进行动脉重建[10]。
与其他组织的细胞相比,胎盘组织的细胞表现出更大的世代倍增时间、增殖潜力、分化能力和表型稳定性。研究发现,胎盘间充质干细胞具有良好的成骨能力,有望作为骨组织工程的种子细胞,用于先天性骨缺损、骨肿瘤、创伤等领域。
截止到2024年4月,在美国临床试验中心ClinicalTrials.gov上注册的关于胎盘和脐带间充质干细胞的临床试验数量已经高达数百项,涉及的适应症包括特发性肺纤维化、佩罗尼病、糖尿病足溃疡、Ⅱ型糖尿病、再生障碍性贫血、强制性脊柱炎、骨髓增生异常综合征、胎儿脊髓脊膜膨出、阳痿、骨关节炎、COVID-19肺炎、移植物抗宿主病、膝关节骨关节炎等。
小结
由此可知,间充质干细胞疗法在实际应用中,其效果展现出了明显的个体差异。这种差异不仅与患者自身的健康状况以及所患疾病的状态紧密相关,还与细胞的给药途径、剂量、细胞的来源、细胞的功能、细胞的制备工艺是否达到要求、最终细胞制剂的质量是否达到要求等因素有关,每一环节的细微变化,都可能带来截然不同的结果。因此,在临床实践中,我们需以更加审慎的态度,精准把握每一个变量,制定适合患者的个性化疗法。
目前,间充质干细胞已经被应用到大量的疾病治疗研究中,未来,随着技术的不断进步和临床经验的积累,间充质干细胞有望成为更多顽疾的克星,为人类健康事业贡献更大的力量。
参考文献:
[1] Mesenchymal stem cells in health and disease | Nature Reviews Immunology[EB/OL]. [2024-07-15]. https://www.nature.com/articles/nri2395.
链接:https://translational-medicine.biomedcentral.com/articles/10.1186/1479-5876-12-8
[2] Ankrum J A, Ong J F, Karp J M. Mesenchymal stem cells: immune evasive, not immune privileged[J]. Nature Biotechnology, 2014, 32(3): 252-260.
链接:https://pubmed.ncbi.nlm.nih.gov/24561556/
[3] Bagno L L, Salerno A G, Balkan W, et al. Mechanism of Action of Mesenchymal Stem Cells (MSCs): impact of delivery method[J]. Expert Opinion on Biological Therapy, 2022[2024-07-18].
链接:https://www.tandfonline.com/doi/abs/10.1080/14712598.2022.2016695
[4] Ikebe C, Suzuki K. Mesenchymal Stem Cells for Regenerative Therapy: Optimization of Cell Preparation Protocols[J]. BioMed Research International, 2014, 2014(1): 951512.
链接:https://onlinelibrary.wiley.com/doi/full/10.1155/2014/951512
[5] Fernández-Santos M E, Garcia-Arranz M, Andreu E J, et al. Optimization of Mesenchymal Stromal Cell (MSC) Manufacturing Processes for a Better Therapeutic Outcome[J]. Frontiers in Immunology, 2022, 13.
链接:https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2022.918565/full
[6] Carp D M, Liang Y. Universal or Personalized Mesenchymal Stem Cell Therapies: Impact of Age, Sex, and Biological Source[J]. Cells, 2022, 11(13): 2077.
链接:https://www.mdpi.com/2073-4409/11/13/2077#B42-cells-11-02077
[7] Stolzing A, Jones E, McGonagle D, et al. Age-related changes in human bone marrow-derived mesenchymal stem cells: Consequences for cell therapies[J]. Mechanisms of Ageing and Development, 2008, 129(3): 163-173.
链接:https://www.sciencedirect.com/science/article/pii/S0047637407001790?via=ihub
[8] Zanotti S, Kalajzic I, Aguila H L, et al. Sex and Genetic Factors Determine Osteoblastic Differentiation Potential of Murine Bone Marrow Stromal Cells[J]. PLoS ONE, 2014, 9(1): e86757.
链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3904935/
[9] Saeedi P, Halabian R, Imani Fooladi AA. A revealing review of mesenchymal stem cells therapy, clinical perspectives and Modification strategies. Stem Cell Investig. 2019 Sep 25;6:34. doi: 10.21037/sci.2019.08.11. PMID: 31620481; PMCID: PMC6789202.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6789202/
[10] Macrin, D., Joseph, J.P., Pillai, A.A. et al. Eminent Sources of Adult Mesenchymal Stem Cells and Their Therapeutic Imminence. Stem Cell Rev and Rep 13, 741–756 (2017).
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
