




引言
日前,英国剑巴伯拉罕研究所的研究人员开发了一种方法,可以将人类皮肤细胞“时间跳跃”30年,在不失去细胞特有功能的情况下逆转细胞的衰老时钟。在这一实验中,他们成功使53岁的中年女性志愿者的皮肤细胞年轻了30岁。这一研究开启了细胞抗衰老的新大门。回望过去,细胞抗衰老疗法经历了漫长的发展历程,目前进入到了以间充质干细胞等多能干细胞为主流的蓬勃发展期。本文通过盘点细胞抗衰老疗法的发展历程,帮助大家了解人类在抗衰老领域的科技步伐。
根据NewScientist的报道,研究人员已经开发出一种方法,可以将皮肤细胞的生物钟拨回30年,从成熟细胞中制造干细胞,未来可用于治疗皮肤疾病。
来自英国剑桥的科学家们发明了一种技术,利用山中因子使皮肤细胞恢复活力,同时又不失去它们以前的功能。研究人员收集了三名平均年龄在50岁左右的供体皮肤细胞样本,然后将这些细胞暴露在山中因子中13天,以部分地延缓细胞衰老。然后去除山中因子,让细胞生长。
随着年龄的增长,我们的DNA会被化学物质标记,所以追踪这些标记可以帮助我们确定身体的年龄。这就是我们的表观遗传时钟。随着时间的推移,我们的一些基因会开启或关闭,这些基因的集合被称为转录组。
研究人员发现,部分重编程细胞的表观遗传时钟和转录组谱与30岁年轻人的皮肤细胞谱相匹配。恢复活力的细胞也像年轻的细胞一样发挥作用,比那些没有经历重编程的细胞产生更多的胶原蛋白。研究人员还发现,重新编程的细胞比未编程的细胞更快促进伤口愈合。
这项研究是细胞抗衰老疗法领域的一个突破。
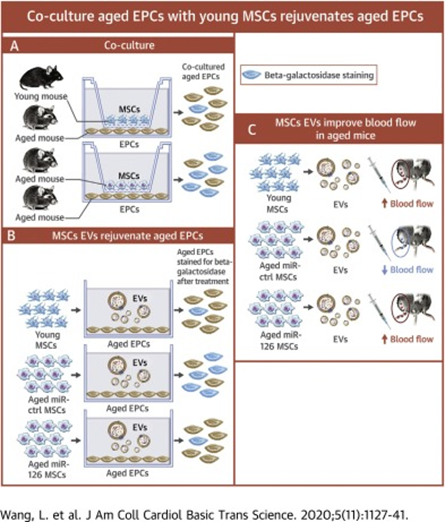
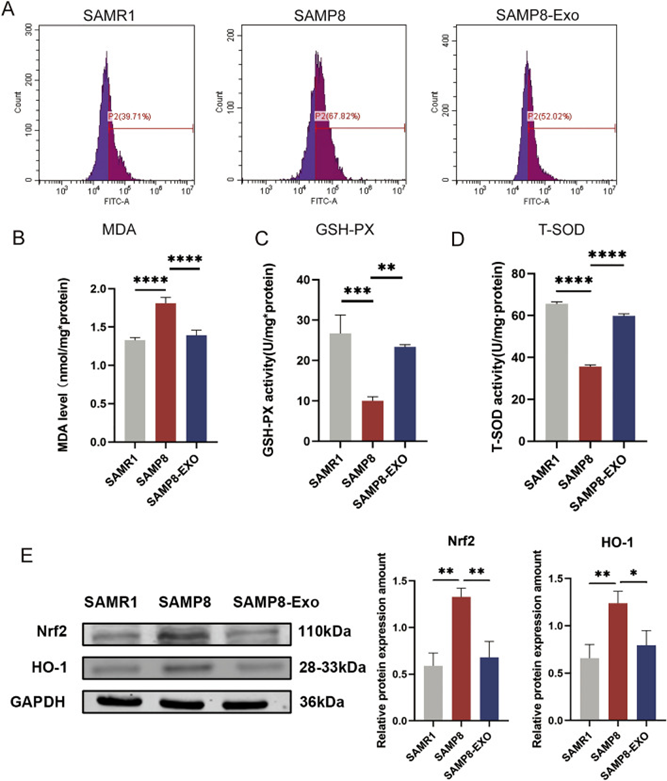
从基因和细胞的层面看衰老 人类的寿命受基因、环境和生活方式的综合影响已是科学共识。衰老是一个复杂的生物过程,涉及到多个层面的变化,包括基因、蛋白质、细胞以及细胞间的通信等。 (1) 干细胞的耗竭 干细胞是人体的各组织器官的祖细胞,是人体再生修复能力的关键。随着人们年龄的增加,干细胞的活力逐渐减弱,其中一个原因是衰老细胞持续释放一种包含促炎和免疫抑制成分的混合物,即所谓的衰老相关分泌表型(SASP)。这会减少干细胞的活性,使得免疫功能衰退以及组织修复能力下降。SASP是广泛存在于多种因素中的“炎症”现象的一部分,这种现象会导致慢性低度炎症,从而破坏干细胞的功能和组织修复能力。 (2)基因层面 基因突变和表观遗传变化被认为是衰老的重要原因之一。随着时间的推移,DNA可能会遭受损伤,导致基因表达的变化,进而影响细胞的正常功能; (3)蛋白质层面 蛋白质折叠错误和聚集也是衰老的关键因素。蛋白质是细胞结构和功能的基石,错误的折叠会导致细胞功能紊乱,甚至引发疾病。 (4)细胞层面 细胞的老化,特别是端粒的缩短,被认为是衰老的一个重要标志。端粒是染色体末端的特殊结构,它们可以保护染色体不受侵害。随着细胞分裂次数的增多,端粒会逐渐缩短,最终导致细胞无法继续分裂,进入衰老状态。 (5)细胞间通信 细胞间的信号传导异常也被认为是衰老的原因之一。细胞通过释放各种信号分子进行交流,这种交流对于维持组织的正常功能至关重要。然而,随着年龄的增长,这种交流可能会变得混乱,导致组织功能下降。 细胞抗衰老疗法的发展历程 随着人类寿命的不断延长,衰老问题却令人担忧。伴随身体功能丧失、健康状况不佳和生活质量下降,衰老的过程中还会导致一系列与年龄增长息息相关的疾病。由此衍生出抗衰老疗法开始崭露头角、蓬勃发展。 抗衰老疗法,也称为年轻化疗法。通过针对衰老的基本机制,抗衰老疗法可延缓年龄相关疾病的发作,促进组织再生的改善以及生理功能的正常化包括一系列旨在减缓、逆转或减轻衰老对健康影响,改善老年生活质量的干预措施(1)。 主流的抗衰老措施一般包括生活方式的调整、抗氧化剂的运用、激素替代疗法、基因编辑、干细胞疗法及这些手段的综合运用。干细胞具有自我更新和分化成多种细胞类型的能力,因此被认为有潜力用于治疗衰老相关的疾病和延缓衰老。 (1)发展初期:干细胞崭露头角 细胞疗法抗衰老的发展历程可追溯至20世纪初。1912年,法国科学家亚历克西斯·卡雷尔提出将胚胎细胞组织植入老化细胞的培养基中,使之恢复生长活力的想法,这被视为细胞疗法的萌芽 。 1931年,瑞士医生保罗-尼汉斯首次将山羊胚胎细胞提取并注射入人体,成功挽救了患者的生命,奠定了细胞疗法的基础 。随后,德国学者西格弗里·布洛克进一步研究并发展了细胞疗法针剂,确保了细胞的活性与纯净性。 2010年,德国的活细胞疗法引进中国,推动了细胞疗法在全球范围内的普及 。至此,细胞疗法在抗衰老研究领域开始蓬勃发展。 (2)发展蓬勃期:间充质干细胞开启新时代 由于人类胚胎干细胞的研究过程涉及使用和破坏人类胚胎,在伦理和政策上一直都有争议,同时胚胎干细胞具有致瘤性,因此这一类细胞的应用和发展具有一定的局限性。 随着抗衰老疗法的研究发展,加之干细胞研究的发展,科学家们发现[2],利用多能干细胞(例如间充质干细胞)的再生和免疫调节特性来恢复组织功能并改善整体健康,这种思路在抗衰老方面具有可行性。 当前,干细胞疗法主要集中在两大领域:一是利用细胞自身的分化能力、修复能力和免疫调节作用来对抗衰老,二是通过细胞分泌的生物活性因子促进组织再生 。 众多研究表明了细胞疗法在抗衰老方面具有巨大潜力。例如,有研究证明从老年小鼠中分离的上皮祖细胞(已衰老)在与间充质干细胞或间充质干细胞囊泡共培养后,可使导致衰老化的上皮祖细胞恢复活力(3)。 图片引用自文献3 这一研究证明了间充质干细胞抗衰老机制的2条理论路径均可行。无论是直接注射干细胞还是选择细胞衍生物均可取得正面效应。 有临床研究表明,在44岁中年患者急性重度胰腺炎早期的标准治疗中纳入间充质干细胞,可以有针对性地、相对快速地干预异常稳态过程、抑制毒性现象、恢复免疫应答和改善微循环(4)。 也有研究表明,天然的间充质干细胞外泌体(MSC-Exos )在体外小胶质细胞培养系BV2中均具有神经保护作用,并在具有加速衰老表型的衰老SAMP8小鼠的大脑中表现出抗凋亡和抗氧化作用(5)。 图片引用自文献5MSC-Exos 减弱了衰老小鼠大脑中氧化应激的增加 这是由于干细胞的抗氧化作用可以帮助清除体内的自由基,防止自由基对细胞造成伤害,从而延缓衰老。 (3)未来拓展期:利用重编程细胞来抗衰 随着基因工程的发展,抗衰老的细胞疗法也在进一步拓展。这方面的主要势涉及使用重编程和转基因的细胞。细胞重编程需要重置细胞的表观遗传状态,将它们恢复到更年轻的状态,目的是逆转细胞衰老和恢复功能。基因编辑技术如CRISPR-Cas9允许科学家直接修改基因,这为修复与衰老有关的基因突变提供了可能(6)。 有研究表明,在衰老过程中诱导的转基因效应免疫细胞,如靶向尿激酶型纤溶酶原激活剂表面受体(uPAR)的CAR T细胞,在体外和体内去除衰老细胞以及恢复诱导纤维化小鼠的组织稳态方面显示出很高的疗效(7)。 图片引用自文献7 CAR T细胞的治疗作用可扩展到其他衰老相关疾病 未来,围绕提高细胞疗法的靶向性、精准性和安全性而开展的研究也将日益增多,例如通过抗体-药物偶联物特异性清除衰老细胞的新策略是此方面的典范。 当然,细胞疗法在抗衰老方面的发展仍面临挑战,其中包括细胞的来源、细胞制备的稳定性、以及细胞疗法的安全性和有效性评估等,因此未来仍然需要具有更多的机构一起努力共同推动这一领域的标准化发展。


小结
作为抗衰老产业的新风口,以干细胞为核心的再生医学在对抗身体衰老和认知能力下降的斗争中将发挥核心作用。健康的细胞是人体对抗疾病和抗衰老的“斗士”。细胞疗法在抗衰老领域经历了漫长的发展历程,目前处于快速发展的阶段。未来的研究将致力于解决现有的挑战,提高细胞疗法的安全性和有效性,以期更加高效的实现延缓衰老、恢复组织功能等方面的潜力。随着科学的发展,我们相信细胞疗法有潜力为人类解决衰老问题带来更多惊喜。
(1) Ros, M.; Carrascosa, J.M. Current nutritional and pharmacological anti-aging interventions. Biochim. Biophys. Acta Mol. Basis Dis. 2020, 1866, 165612.
(2) Kitaeva, K.V.; Solovyeva, V.V.; Blatt, N.L.; Rizvanov, A.A. Eternal Youth: A Comprehensive Exploration of Gene, Cellular, and Pharmacological Anti-Aging Strategies. Int. J. Mol. Sci. 2024, 25, 643. https://doi.org/10.3390/ijms25010643
(3) Wang, L.; Wei, J.; Da Fonseca Ferreira, A.; Wang, H.; Zhang, L.; Zhang, Q.; Bellio, M.A.; Chu, X.M.; Khan, A.; Jayaweera, D.; et al. Rejuvenation of Senescent Endothelial Progenitor Cells by Extracellular Vesicles Derived From Mesenchymal Stromal Cells. JACC Basic Transl. Sci. 2020, 5, 1127–1141.
(4) Gasanova, S.Y. Cell therapy for destructive pancreatitis. Khirurgiia 2022, 9, 50–55.
(5) Zhang, X.; Liu, T.; Hou, X.; Zhou, Z.; Zhang, F.; Ma, H.; Wu, X.; Jiang, J. Exosomes secreted by mesenchymal stem cells delay brain aging by upregulating SIRT1 expression. Sci. Rep. 2023, 13, 13213.
(6) Hatada I, Morita S, Horii T. CRISPR/Cas9. Methods Mol Biol. 2023;2637:41-47. doi: 10.1007/978-1-0716-3016-7_3. PMID: 36773136.
(7) Amor, C.; Feucht, J.; Leibold, J.; Ho, Y.J.; Zhu, C.; Alonso-Curbelo, D.; Mansilla-Soto, J.; Boyer, J.A.; Li, X.; Giavridis, T.; et al. Senolytic CAR T cells reverse senescence-associated pathologies. Nature 2020, 583, 127–132.
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
