




引言
近日,“国内干细胞治愈严重2型糖尿病患者,并停用胰岛素33个月”振奋了整个医药圈,这也是我国干细胞与再生医学领域的重大突破。这是国际上首次利用干细胞技术成功再生人类胰岛组织,为再生医学治疗糖尿病开辟了新的道路。同时,这项研究也为我们揭示了干细胞在再生医学中的巨大潜力。除干细胞再生胰岛组织外,早期仍有为患者移植利用干细胞诱导分化的胰岛细胞和直接输注干细胞等方案。近年来,通过直接回输成体干细胞,尤其是回输间充质干细胞来治疗糖尿病的研究成果不断输出,这一路径也成为了糖尿病治疗的新研究趋势。今天我们通过梳理文献,盘点干细胞治疗糖尿病在这几年获得的重要突破。
糖尿病包括2个分型,及1型糖尿病和2型糖尿病,多数患者还伴随着糖尿病足、糖尿病视网膜病变、糖肾、酮症酸中毒等多种并发症。尤其在老年人中发病率较高,甚至多数患者终生与胰岛素为伴。随着再生医学的发展,学术界不断产生干细胞疗法有效治疗糖尿病的硕果。今天我们通过梳理文献,盘点干细胞疗法治疗糖尿病的重要突破。
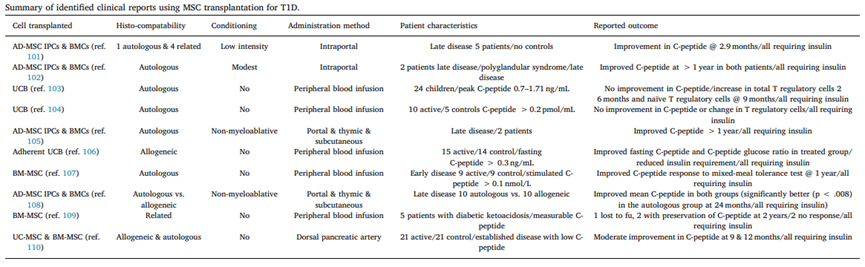
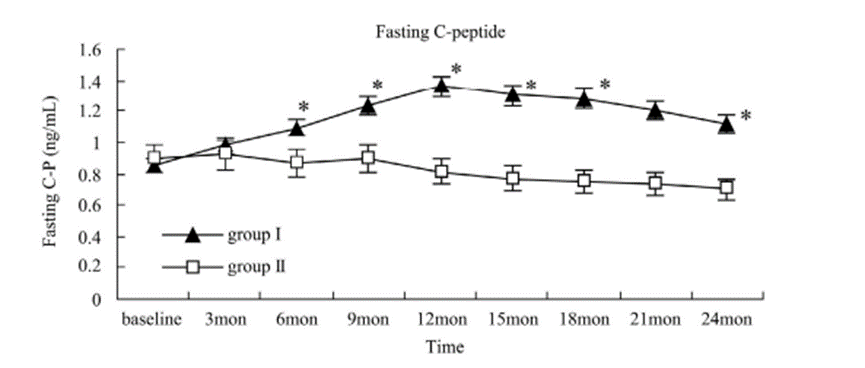
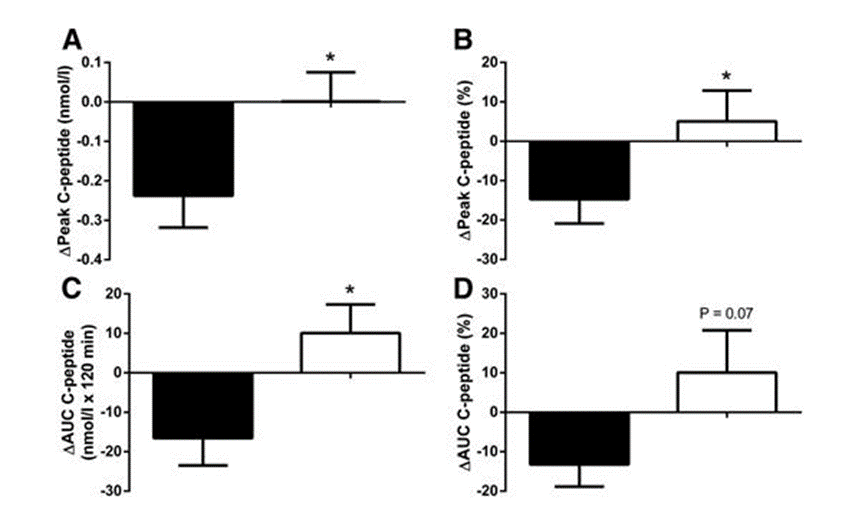
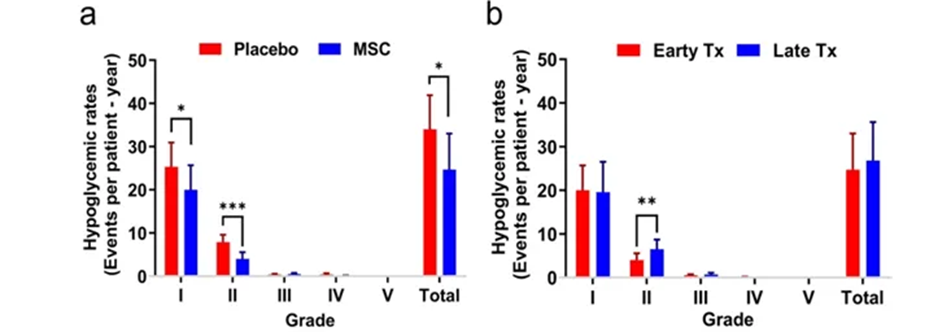
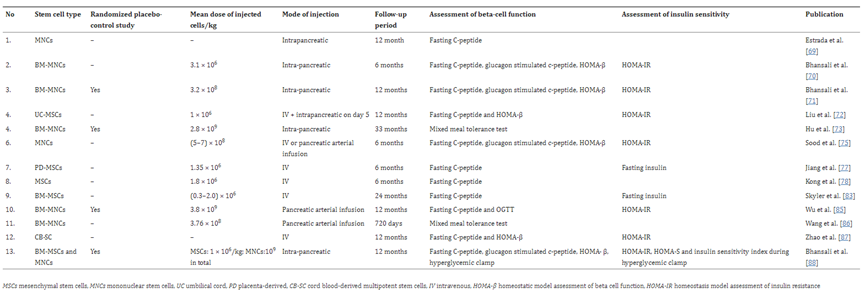
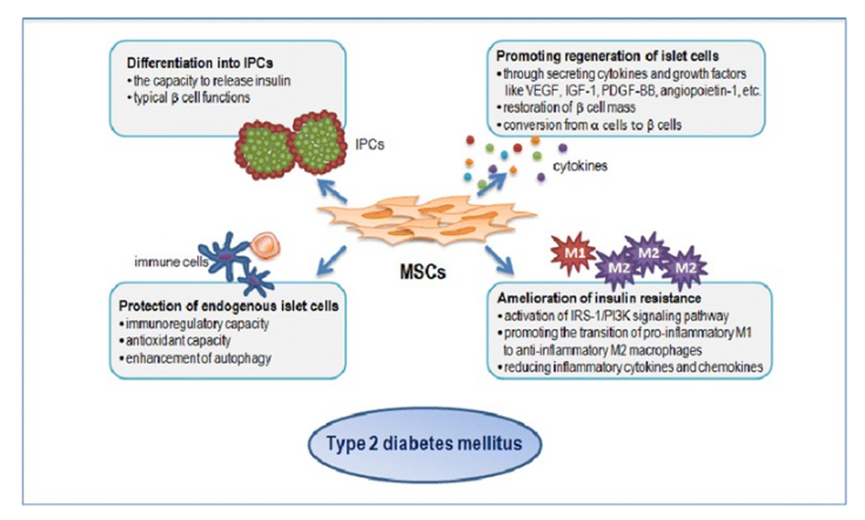
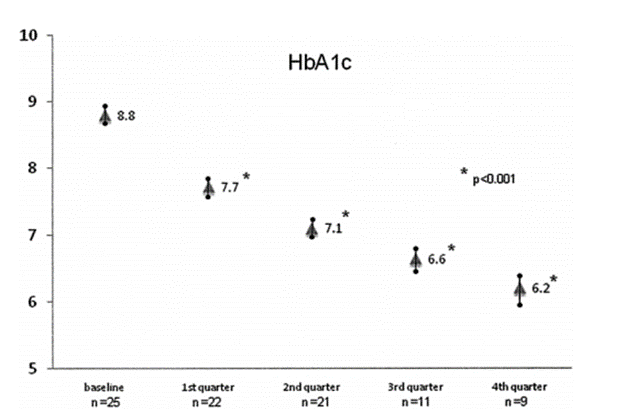
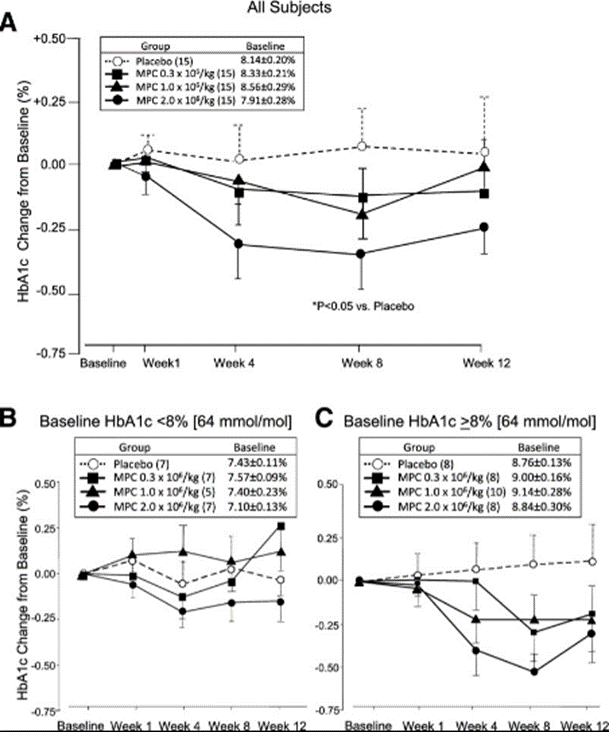
突破一:干细胞来源自体再生胰岛移植,成功治愈25年糖尿病史患者 如何在体外高效地再生人类胰岛组织,一直是困扰科学界的一大难题,并备受全球关注。来自海军军医大学上海长征医院和中国科学院分子细胞科学卓越创新中心的研究团队在权威杂志Cell Discovery(中科院1区,IF=33.5)在线发表最新研究成果。 团队通过创新性地利用患者的血液PBMC重编程为自体iPSC细胞,进一步诱导成为内胚层干细胞(EnSC),最终在体外再造胰岛组织(E-islet)。 这项技术的成功实施,已经让一位患有25年糖尿病历史的患者得到了治愈。这位患者在接受治疗后已经完全摆脱了对胰岛素的依赖,并且已经持续了33个月。 这是国际上首次利用干细胞来源的自体再生胰岛移植,成功治愈胰岛功能严重受损糖尿病的病例报道。 突破二:回输间充质干细胞,重塑胰岛功能,对I型和II型糖尿病均有效果 除干细胞再生胰岛组织外,早期仍有为患者移植利用干细胞诱导分化的胰岛细胞和直接输注干细胞等方案。近年来,通过直接回输成体干细胞,尤其是回输间充质干细胞来治疗糖尿病的研究成果不断输出,这一路径也成为了糖尿病治疗的新研究趋势。 大量临床试验表明,间充质干细胞回输可以明显改善1型及2型糖尿病者的血糖代谢紊乱,恢复受损胰岛的胰岛素分泌;多项已经完成或正在进行的临床I/II期试验均提示:间充质干细胞回输可以有效逆转糖尿病患者的高血糖,重塑胰岛功能,且无明显不良反应的发生。 (1)间充质干细胞回输帮助1型糖尿病患者改善C肽水平 Ⅰ型糖尿病(T1D)因免疫系统受损而导致代谢异常,是一种代谢性疾病,其特征是分泌胰岛素的β细胞被自身免疫性错误的破坏,导致胰岛素缺乏而引起高血糖。目前临床应用间充质干细胞治疗T1D的案例不在少数,包括孤立的病例报告和不同水平的对照研究,同种异体移植和自体移植均已被尝试。所有报告都表明手术方案是安全的,没有关于死亡案例(1)。 图片引用自文献1 案例一:一项双盲研究中,实验组患者采用静脉输注间充质干细胞,用量为50 mL,细胞数在1.5~3.2×10^7(平均值为2.6±1.2×10^7)。结果表明,使用间充质干细胞移植后,28名1型糖尿病患者近2年内C肽水平的持续改善(2)。 图片引用自文献2 案例二:另有一项完全对照研究,使用患者自体间充质干细胞,一次性静脉滴注自体细胞2.1-3.6×10^6个/kg(中位数2.75×10^6个/kg)。结果证实,患者的C肽水平在一年后得到保留或改善(3)。 图片引用自文献3 案例三:一项发表在Stem Cell Research &Therapy的随机安慰剂对照临床试验表明,21名Ⅰ型糖尿病患者在接受剂量为每公斤体重1*10^6个自体间充质干细胞的细胞治疗后,有效降低了低血糖发生的频率,这种方法还改善了患者的代谢指标并调节其免疫力反应(4)。 图片引用自文献4 (2)间充质干细胞回输,帮助2型糖尿病患者改善胰岛抵抗 目前已有近百项在2型糖尿病患者中进行的第I/II期临床研究。其中,已经发表了13篇评价间充质干细胞治疗2型糖尿病临床效果的论文(5)。 间充质干细胞通过促进胰岛细胞再生、保护内源性胰岛细胞和改善胰岛素抵抗等途径对2型糖尿病的治疗发挥有益作用。 MSCs作用于2型糖尿病的机制的图表。图片引用自文献5 案例一:早在2008年,埃斯特拉达等人首先发现BM-MSC移植联合高压氧治疗(HOT)可有效降低T2DM患者的HbA1c水平达1年(6)。 图片引用自文献6 案例2:在治疗2型糖尿病中应用的间充质干细胞的数量和治疗结果之间存在直接的相关性。在一项随机、安慰剂对照、剂量递增研究中,口服抗糖尿病药物控制不充分的2型糖尿病患者,接受注射剂量分别为0.3×10^6/kg、1.0×10^6/kg或2.0×10^6/kg 的间充质干细胞,研究持续12周。结果显示,接受2.0×10^6/kg剂量的患者中有33%的患者达到了目标HbA1c(7)。 图片引用自文献7 案例3:我国研究者在Stem Cell Research & Therapy杂志发表间充质干细胞治疗中国成人2型糖尿病的疗效和安全性的II期临床试验结果。此研究共纳入了91名2型糖尿病患者(T2D),分为间充质干细胞治疗组与安慰剂组,随访48周(8)。 图片引用自文献8 结果发现间充质干细胞治疗组20%患者的糖化血红蛋白(HbA1c)水平<7.0%,且每日胰岛素用量减少一半以上,此外,间充质干细胞治疗组的HbA1c水平下降1.31%。对比安慰剂组,安慰剂组仅有4.55%患者达到了HbA1c<7.0%,而整体HbA1c仅下降了0.63%。 综上所述,间充质干细胞治疗显著改善了T2D,且治疗及随访期间无相关不良反应。 突破三:干细胞来源胰岛细胞移植,帮助患者“摆脱”胰岛素注射 胰岛 β 细胞的再生和替代治疗被认为是治愈I型糖尿病的有效途径。2023年7月,北大干细胞研究中心与天津市第一中心医院合作,成功完成了国际首例1型糖尿病受试者化学重编程诱导多潜能干细胞分化的胰岛细胞移植手术。该治疗技术有望成为彻底治愈1型糖尿病的理想方案。 受试者是一位病史长达11年的1型糖尿病患者,在接受细胞移植当天便恢复了正常活动,并且胰岛细胞存活良好。移植后第10天,患者血糖稳定,每日胰岛素需要量已经降低至移植前的一半。该治疗技术有望成为彻底治愈1型糖尿病的理想方案。 日前,国际权威期刊NATURE旗下子刊《Nature Biotechnology》发表发表了一项研究数据[11],研究人员使用了充满实验室培养的干细胞衍生的胰腺细胞VC-02的微型植入物,对10名I型糖尿病患者进行了测试,这10名患者在研究开始时均不能自然产生胰岛素。植入6个月后,其中3例有明显改善。他们的身体在正常血糖范围内的时间更长,并减少了对外部胰岛素的需求。研究人员表示,“我们的希望是让这些细胞足够强大,以帮助完全停止注射胰岛素,” 突破四:供体来源胰岛细胞移植治疗糖尿病获批上市 美国时间2023年6月28日,FDA批准了首个针对I型糖尿病患者的细胞疗法上市。这是CellTrans公司开发的同种异体胰岛细胞疗法——Lantidra,被批准用于治疗反复发生严重低血糖,强化糖尿病管理和教育后仍无法接近目标糖化血红蛋白的I型糖尿病患者。 这款细胞疗法的作用机制是,在患者体内输注这些同种异体β细胞后,可以产生足够的胰岛素,这样一来,患者就不再需要注射胰岛素来控制自身的血糖水平。这款疗法通过肝门静脉单次给药,根据患者对初始剂量的反应,可以进行额外的Lantidra输注。 两项非随机、单组研究评估了这款细胞疗法的安全性和有效性。共有30名I型糖尿病和低血糖无意识的患者参与,他们接受了至少一次输注和最多三次输出。结果显示,其中的21名患者在接受治疗后1年以上不需要服用胰岛素,11名患者在接受治疗后1~5年不需要胰岛素,10名患者5年以上不需要胰岛素。 突破五:其他干细胞移植治疗糖尿病,取得临床积极效果 目前来说,用于糖尿病治疗的干细胞除间充质干细胞外,还有最常用的是骨髓单核干细胞(BM-MNC)、造血干细胞(HSC)等。 外周血干细胞移植:曾有学者采用介入法经股动脉至脾动脉处移植外周血干细胞。结果移植后3个月、6个月,患者糖代谢紊乱情况改善。尤其是6个月后,患者FBG、2 h PG、HbALc均较移植前显著下降,胰岛B细胞功能明显改善。降血糖药物用量明显减少(3个月、6个月胰岛素促泌剂用量自身对照P<0.01。胰岛素用量自身对照,3个月P<0.01,6个月P<0.05)(9)。 骨髓单核干细胞移植:一项研究中,6例2型糖尿病(T2D)患者接受了自体骨髓单核干细胞(BM-MNSC)输注腹腔和肠系膜上动脉,未经任何清髓或免疫抑制治疗的预处理。6例患者中有5例(83%)的空腹血糖和糖化血红蛋白(HbA1C)恢复正常,用药需求显著减少。HbA1C平均下降2.2点(10)。三名糖尿病并发症患者表现出改善或稳定,大多数患者报告能量和耐力有所改善。反应持续时间从6个月到2年不等。没有患者出现任何明显的不良反应。 图片引用自文献10


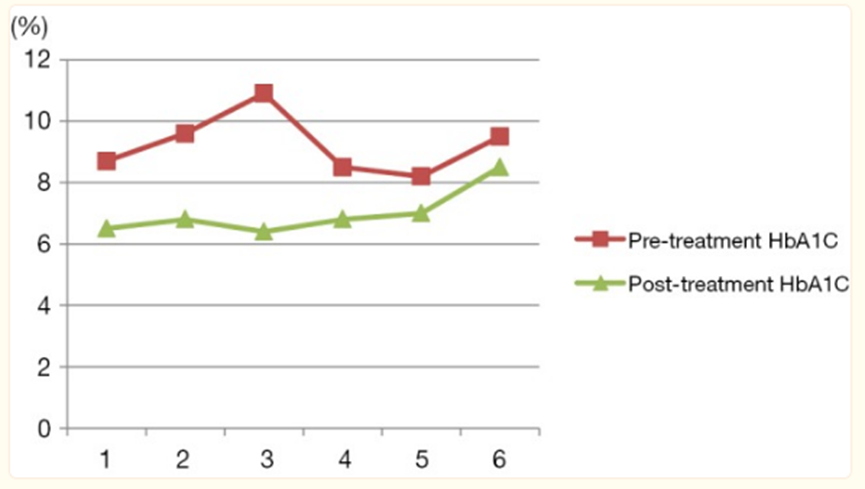
这些进展表明,干细胞与再生医学在治疗糖尿病方面有着巨大的潜力和前景,尽管目前的绝大多数研究仍处于临床试验阶段,但成功的案例为未来的应用提供了希望。
小结
恢复胰岛素独立性和恢复正常血糖一直是糖尿病研究和治疗的首要目标。目前,人类干细胞来源的、可以产生胰岛素的胰岛细胞,或者是能进行细胞移植的细胞疗法成为治疗糖尿病及其并发症的新希望。目前,利用干细胞治疗糖尿病,为糖尿病的治疗提供了新的思路和方法,有望帮助更多的糖尿病患者摆脱长期依赖胰岛素的生活。随着研究的深入,未来会有更多的治疗方案可供患者选择。
(1) Pixley JS. Mesenchymal stem cells to treat type 1 diabetes. Biochim Biophys Acta Mol Basis Dis. 2020 Apr 1;1866(4):165315. doi: 10.1016/j.bbadis.2018.10.033. Epub 2018 Nov 30. PMID: 30508575.
(2) J. Hu, X. Yu, Z. Wang, F. Wang, L. Wang, H. Gao, Y. Chen, W. Zhao, Z. Jia, S. Yan, Y. WangLong term effects of the implantation of Wharton's jelly-derived mesenchymal stem cells from the umbilical cord for newly-onset type 1 diabetes mellitusEndocr. J., 60 (3) (2013), pp. 347-357(Epub 2012 Nov 16. PubMed PMID: 23154532)
(3) P.O. Carlsson, E. Schwarcz, O. Korsgren, K. Le Blanc Preserved β-cell function in type 1 diabetes by mesenchymal stromal cells Diabetes, 64 (2) (Feb 2015), pp. 587-592, 10.2337/db14-0656(Epub 2014 Sep 9. PubMed PMID: 25204974)
(4) Izadi M, Sadr Hashemi Nejad A, Moazenchi M, Masoumi S, Rabbani A, Kompani F, Hedayati Asl AA, Abbasi Kakroodi F, Jaroughi N, Mohseni Meybodi MA, Setoodeh A, Abbasi F, Hosseini SE, Moeini Nia F, Salman Yazdi R, Navabi R, Hajizadeh-Saffar E, Baharvand H. Mesenchymal stem cell transplantation in newly diagnosed type-1 diabetes patients: a phase I/II randomized placebo-controlled clinical trial. Stem Cell Res Ther. 2022 Jun 20;13(1):264. doi: 10.1186/s13287-022-02941-w. PMID: 35725652; PMCID: PMC9208234.
(5) Zang L, Hao H, Liu J, Li Y, Han W, Mu Y. Mesenchymal stem cell therapy in type 2 diabetes mellitus. Diabetol Metab Syndr. 2017 May 15;9:36. doi: 10.1186/s13098-017-0233-1. PMID: 28515792; PMCID: PMC5433043.
(6) Estrada EJ, Valacchi F, Nicora E, Brieva S, Esteve C, Echevarria L, Froud T, Bernetti K, Cayetano SM, Velazquez O, Alejandro R, Ricordi C. Combined treatment of intrapancreatic autologous bone marrow stem cells and hyperbaric oxygen in type 2 diabetes mellitus. Cell Transplant. 2008;17(12):1295-304. doi: 10.3727/096368908787648119. PMID: 19364067.
(7) Skyler JS, Fonseca VA, Segal KR, Rosenstock J; MSB-DM003 Investigators. Allogeneic Mesenchymal Precursor Cells in Type 2 Diabetes: A Randomized, Placebo-Controlled, Dose-Escalation Safety and Tolerability Pilot Study. Diabetes Care. 2015 Sep;38(9):1742-9. doi: 10.2337/dc14-2830. Epub 2015 Jul 7. PMID: 26153271; PMCID: PMC4542273.
(8) Li Zang, et al. Efficacy and safety of umbilical cord derived mesenchymal stem cells in Chinese adults with type 2 diabetes: a single center, double blinded, randomized, placebo controlled phase II trial. Stem Cell Res Ther. 2022, 13 (1):180.
(9) 王志同,张雪菊,刘慧敏,张爱民,谢茂玲,王志效.自体外周血干细胞移植治疗糖尿病60例临床观察[J].济宁医学院学报,2011,34(3):180-182
(10) Wehbe T, Chahine NA, Sissi S, Abou-Joaude I, Chalhoub L. Bone marrow derived stem cell therapy for type 2 diabetes mellitus. Stem Cell Investig. 2016 Dec 6;3:87. doi: 10.21037/sci.2016.11.14. PMID: 28066789; PMCID: PMC5182211.
[11] Keymeulen B, De Groot K, Jacobs-Tulleneers-Thevissen D, Thompson DM, Bellin MD, Kroon EJ, Daniels M, Wang R, Jaiman M, Kieffer TJ, Foyt HL, Pipeleers D. Encapsulated stem cell-derived β cells exert glucose control in patients with type 1 diabetes. Nat Biotechnol. 2023 Nov 27. doi: 10.1038/s41587-023-02055-5. Epub ahead of print. PMID: 38012450
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
