




引言
已有多项临床前研究表明,间充质干细胞可以有效发挥免疫调节作用,以治疗因Th2 型免疫过度激活而导致的特异性皮炎。本文通过分析文献,帮助大家了解间充质干细胞治疗特应性皮炎的益处以及临床结果。34 名患有中度至重度特应性皮炎的成年患者进行了皮下注射间充质干细胞后,均可观察到症状的改善,相对于低剂量组(2.5×10^ 7);高剂量组(5×10 ^7个细胞)的效果更佳。
近年来,随着节奏的加快,过敏体质伴随着过敏性疾病增多,给很多人的生活带来了困扰。例如,在生活中,从刚出生的小宝宝,到年过半百的中老年人,都可能遭受反复皮肤瘙痒折磨,寝食难安~这可能是特应性皮炎在作祟。

图片来自站酷海洛
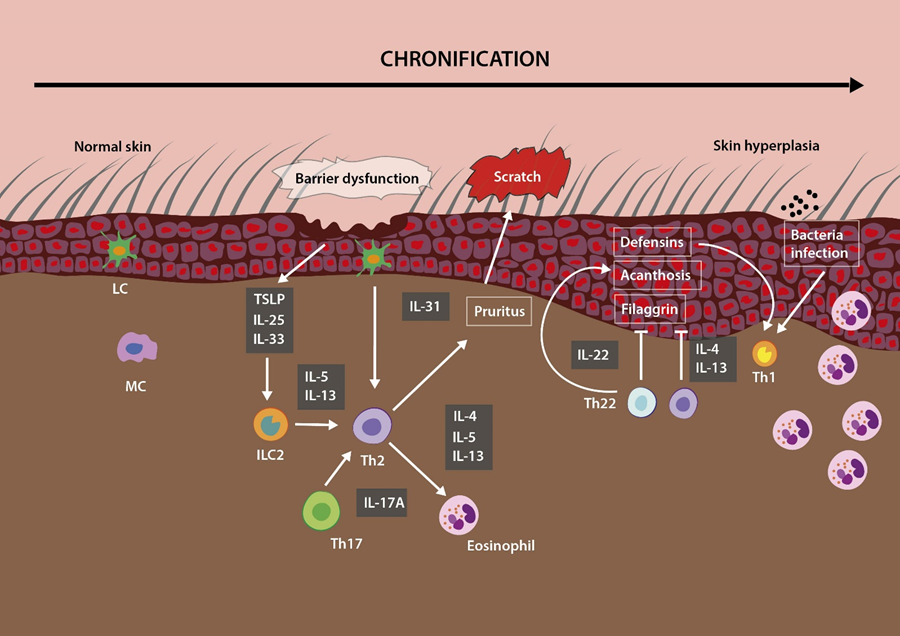
湿疹,你了解多少? 特应性皮炎 (AD) ,俗称特应性湿疹,是一种典型的慢性复发性皮肤病,其特征是湿疹性皮肤损害和严重瘙痒、皮肤屏障功能受损、Th2 型免疫过度激活以及血清免疫球蛋白 E 水平升高。 特应性皮炎的发病机制是多因素的,包括遗传因素、表皮屏障缺陷和免疫致病因素等。特应性皮炎的初始病程以双相炎症为特征,其中,辅助性 T 2 (Th2) 淋巴细胞激活及其释放的细胞因子会导致免疫球蛋白 E (IgE) 产生增加,加重皮肤炎症。Th2 型炎症占主导地位,多种细胞因子水平升高,包括白细胞介素 4 (IL-4)、IL-13、IL-17、IL-22、IL-31和胸腺基质淋巴细胞生成素 (TSLP)[1]。 特应性皮炎的治疗一般基于药物干预,通过使用皮质类固醇、钙调神经磷酸酶抑制剂、白三烯受体拮抗剂和抗组胺药[3]。然而,此类药物的使用只能暂时缓解症状,而且在长期治疗中会引起各种不良反应和耐药性[4]。 图片来自站酷海洛 由于特应性皮炎的发病机制是多因素的,单一的治疗方法很难达到疾病控制的目的。间充质干细胞(MSC)是细胞治疗领域最常用的干细胞。间充质干细胞拥有自我更新和分化能力,具有巨大的组织修复潜力,并且可通过调节先天性和适应性免疫系统的免疫细胞的增殖、募集和功能,被认为是免疫系统的强大调节剂[5]。 间充质干细胞治疗特应性皮炎的益处 已有多项研究表明,来自人多个组织 的 间充质干细胞 可以通过调节多个靶点来抑制特应性皮炎的过敏进展。这是由MSC的特征和免疫调节特性决定的。 间充质干细胞的益处主要归因于其分泌的各种生物活性可溶性物质的旁分泌作用。 在最初的间充质干细胞注射过程中,那些分泌的可溶性物质会刺激宿主细胞,以实现免疫调节、血管生成和抗凋亡作用。 由于其调节先天性和适应性免疫系统的能力,间充质干细胞成为治疗多种疾病(主要是损伤组织和免疫介导的疾病)的有力工具[6]。 图片引用自文献2 在一项研究中,作者证明了间充质干细胞通过抑制肥大细胞(MC)脱颗粒,对粉尘螨( Df ) 诱导的特应性皮炎小鼠产生了显著的保护和治疗作用。并且,与静脉内(IV)给药相比,局部皮下(SC)注射间充质干细胞的保护作用更为显著[7]。 研究者又在粉尘螨诱导的特应性皮炎小鼠模型中通过静脉注射比较了两种不同剂量(低剂量:2 × 10^5;高剂量:2 × 10 ^6)的间充质干细胞作用效果。在这项研究中,高剂量的间充质干细胞显著降低了小鼠 特应性皮炎 的临床严重程度。 正如前文所述,特应性皮炎的发病机制主要与T细胞异常有关,尤其是CD4 + T细胞异常。根据产生的细胞因子的概况,可以分为Th1或Th2细胞,这两种细胞在AD发病机制中都发挥着关键作用。而间充质干细胞对淋巴细胞功能具有很强的免疫调节作用[8],包括在AD模型中显示的免疫调节作用。 图片引用自文献2 在特应性皮炎的情况下,间充质干细胞对T细胞的影响还体现在对T 细胞增殖和细胞因子(IFNγ 和 IL-4)产生的抑制。这一结论在2014年一项研究的体外实验间充质干细胞与 T 淋巴细胞的共培养中得到验证[9]。 案例分享:间充质干细胞有效改善湿疹症状 近年来,越来越多的研究者将间充质干细胞应用到特应性皮炎患者的治疗研究中。有研究者对 34 名患有中度至重度 特应性皮炎 的成年患者进行了皮下注射间充质干细胞。 这项临床使用了两种测试剂量——低剂量组为2.5×10^ 7;高剂量组为5×10 ^7,在两种剂量的治疗组中,均观察到特应性皮炎症状的改善。 图片引用自文献2 特别是,接受较高剂量间充质干细胞治疗的组 11 名受试者中,有 6 名 (55%) 患者的严重指数(EASI)评分降低了 50%,且没有出现副作用。此外,患者治疗后血清IgE水平和嗜酸性粒细胞数量(AD的典型生物标志物)也有所下降[10]。另外,仍有相关的临床试验正在进行当中。



表格引用自文献11
小结
凭借调节先天性和适应性免疫系统的能力,间充质干细胞成为治疗免疫相关性疾病的有力工具。临床前研究中产生的治疗功效和作用机制的证据表明,基于间充质干细胞的细胞疗法是治疗特应性皮炎的一种有前途的方法。无论是在动物试验,还是人体临床试验,均显示出了间充质干细胞有潜力帮助特应性皮炎患者改善病情,未来,间充质干细胞在治疗免疫相关性疾病领域的研究将继续扩大。对于患者而言,无疑这是值得期待的事。
[1] Chaudhary, S. K., Singh, S. K., Kumari, P., Kanwal, S., Soman, S. P., Choudhury, S., et al. (2019). Alterations in circulating concentrations of IL-17, IL-31 and total IgE in dogs with atopic dermatitits. Vet. Dermatol. 30:383-e114. doi: 10.1111/vde.12762
[2] Daltro SRT, Meira CS, Santos IP, Ribeiro Dos Santos R, Soares MBP. Mesenchymal Stem Cells and Atopic Dermatitis: A Review. Front Cell Dev Biol. 2020 May 14;8:326. doi: 10.3389/fcell.2020.00326. PMID: 32478072; PMCID: PMC7240073.
[3] Ring, J., Alomar, A., Bieber, T., Deleuran, M., Fink-Wagner, A., Gelmetti, C., Gieler, U., Lipozencic, J., Luger, T., Oranje, A.P., Schäfer, T., Schwennesen, T., Seidenari, S., Simon, D., Ständer, S., Stingl, G., Szalai, S., Szepietowski, J.C., Taïeb, A., Werfel, T., Wollenberg, A. and Darsow, U. (2012), Guidelines for treatment of atopic eczema (atopic dermatitis) Part I. Journal of the European Academy of Dermatology and Venereology, 26: 1045-1060.
[4] Meagher, L. J., Wines, N. Y., and Cooper, A. J. (2002). Atopic dermatitis: review of immunopathogenesis, and advances in immunosuppressive therapy. Australas. J. Dermatol. 43, 247–254. doi: 10.1046/j.1440-0960.2002.00610.x
[5] Poggi, A., and Zocchi, M. R. (2019). Immunomodulatory properties of mesenchymal stromal cells: still unresolved “Yin and Yang”. Curr. Stem. Cell Res. Ther. 14, 344–350. doi: 10.2174/1574888X14666181205115452
[6] Golchin, A., Farahany, T. Z., Khojasteh, A., Soleimanifar, F., and Ardeshirylajimi, A. (2019). The clinical trials of mesenchymal stem cell therapy in skin diseases: an update and concise review. Curr. Stem Cell Res. Ther. 14, 22–33. doi: 10.2174/1574888X13666180913123424
[7] Loukogeorgakis, S. P., and De Coppi, P. (2017). Concise review: amniotic fluid stem cells: the know, the unknow, and potential regenerative medicine applications. Stem Cells 35, 1663–1673. doi: 10.1002/stem.2553
[8] Lu, L. L., Liu, Y. J., Yang, S. G., Zhao, Q. J., Wang, X., Gong, X., et al. (2006). Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoesis-supportive function and other potentials. Haematologica 91, 1017–1026.
[9] Na, K., Yoo, H. S., Zhang, Y. X., Choi, M. S., Lee, K., Yi, T. G., et al. (2014). Bone marrow-derived clonal mesenchymal stem cells inhibit ovalbumin-induced atopic dermatitis. Cell Death Dis. 5:e1345. doi: 10.1038/cddis.2014.299
[10] Kim, H. S., Lee, J. H., Roh, K. H., Jun, H. J., Kang, K. S., and Kim, T. Y. (2017). Clinical trial of human umbilical cord blood-derived stem cells for the treatment of moderate-to-severe atopic dermatitis: phase I/IIa studies. Stem Cells 35, 248–255. doi: 10.1002/stem.2401
[11] Najera J, Hao J. Recent advance in mesenchymal stem cells therapy for atopic dermatitis. J Cell Biochem. 2023 Feb;124(2):181-187. doi: 10.1002/jcb.30365. Epub 2022 Dec 28. PMID: 36576973.
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
