




引言
近年来,间充质干细胞被广泛应用到癌症等疾病的治疗研究中,并且被证实具有对抗癌症的巨大潜力。本文盘点间充质干细胞抗癌的三大路径:间充质干细胞外泌体对抗癌症、间充质干细胞作为靶向药载体对抗癌症,间充质干细胞抑制癌症药物副作用,帮助大家认识间充质干细胞与癌症的“博弈”过程。
根据不断的实验及尝试,人们一致认为间充质干细胞是对抗癌症的有力武器。根据综述表明[1],间充质干细胞在癌症治疗领域扮演着重要角色,被广泛用于癌症领域相关研究和治疗。在癌症患者中,基于间充质干细胞的先进细胞疗法被证明是安全的,不过目前其临床疗效有限,未来,可以通过基因工程、膜修饰等提升间充质干细胞迁移和肿瘤杀伤活性,使之成为更为强大的“抗癌智能武器”。

研究发现,间充质干细胞可以通过多种方式来达到对抗癌症的目的,包括间充质干细胞外泌体对抗癌症、间充质干细胞作为靶向药载体对抗癌症,间充质干细胞抑制癌症药物副作用等。接下来我们具体总结一下这三种路径。
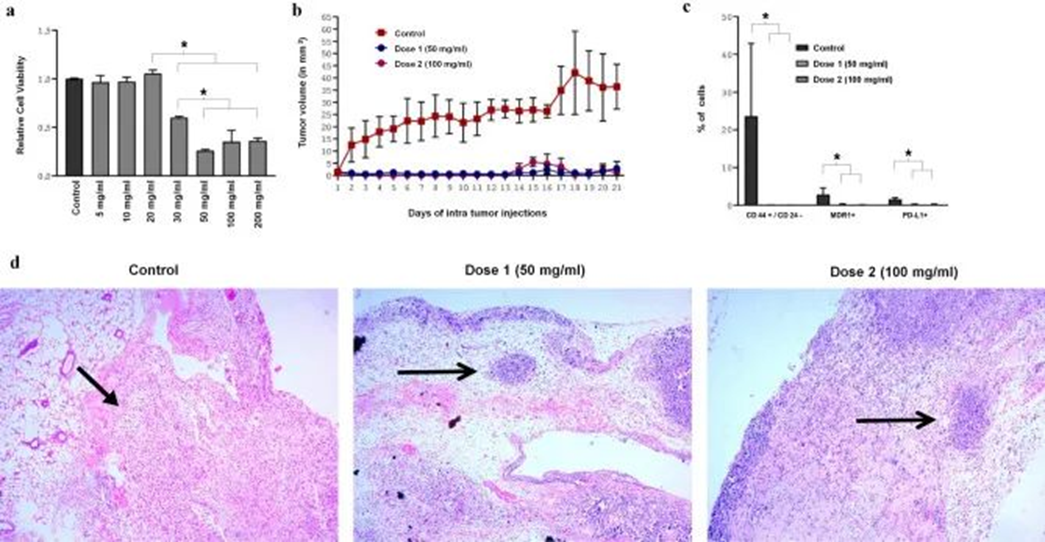
路径一: 间充质干细胞外泌体抑制肿瘤 近年来,间充质干细胞外泌体被广泛应用癌症等疾病的治疗研究中。外泌体是小颗粒细胞外囊泡,就像一艘“货船”一样,内含有蛋白质、核酸、脂质等”货物”,在各种疾病中发挥重要作用。其组成也受环境和药物影响,在不同疾病中具有变化。 间充质干细胞来源的外泌体含有丰富的蛋白质、mRNA和miRNA,可有效发挥抑制肿瘤的作用,其蛋白质组包括膜蛋白和可溶性蛋白在细胞间通信、组织再生和临床应用中发挥重要作用。 今天给大家分享的这篇名为“Mesenchymal stem cell-derived exosomes as a new therapeutic strategy in the brain tumors”的新综述[2]就重点阐述了间充质干细胞来源的外泌体的特性及其在脑部恶性肿瘤治疗中的应用前景。 图片来自参考文献2 由于有血脑屏障(BBB)的存在,导致许多药物无法进入脑部病灶发挥作用,使得其成为治疗药物无法触及到的“禁区”。而间充质干细胞外泌体凭借其独特的性质拥有着“禁区”的两大“通行证”,一是被内皮细胞这个“禁区守门人员”吸收并转运到病灶细胞,二是通过内皮细胞之间(可以理解为两守门人员之间的无人看管的区域)的连接直接进入CNS发挥作用。 发表于《scientific reports》[3]的一篇文章展示了脂肪间充质干细胞外泌体抑制耐药三阴性乳腺癌(TBNC)生长的潜在治疗作用,研究人员首先获得了干细胞外泌体,在体外实验证实当外泌体浓度超过20 mg/ml时,耐药三阴性乳腺癌细胞会被显著杀死。之后构建了TNBC小鼠模型,证实了干细胞外泌体对于耐药三阴性乳腺癌的抑制作用。 图片来自文献3 路径二: 间充质干细胞作为抗癌药物的“精准”运送工具 近年来,比较火热的领域是“利用间充质干细胞来做肿瘤靶向药物的载体”。这些干细胞就像快递卡车,可以将药物带到特定的位置,并将有效的药剂直接输送至肿瘤处。 间充质干细胞(MSC)获取途径广泛、具有强大的再生能力、抗炎能力、免疫抑制、肿瘤归巢、固有的抗癌能力等特性,这些优点使得间充质干细胞成为抗癌病毒的合适载体。 伊朗德黑兰AJA医科大学相关研究团队在cell communication and signaling 杂志发表了一篇综述[4],回顾总结了以间充质干细胞(MSC)为载体的溶瘤病毒的特征及其对肿瘤的活性,并探讨了其抗癌作用及面临的挑战。 溶瘤病毒(OV)是天然存在或基因操纵的病毒,仅在肿瘤细胞中复制和生长,在杀死肿瘤细胞的同时不损害正常细胞。溶瘤病毒疗法作为一种新的癌症治疗方法,提供了多种益处,包括杀伤效率高、靶向性强、无交叉耐药性以及安全性高等,这些优点使得其成为未来最具有潜力和应用前景的癌症治疗手段之一。 (1)间充质干细胞+溶瘤病毒,强强联合对抗癌症 MSC作为OV的载体后,在病毒治疗过程中不仅可以抑制局部炎症,还允许溶瘤病毒在不受免疫限制的情况下复制和破坏癌细胞的基本特征,达到强强联合杀死肿瘤的目的。 [4]基于间充质干细胞的溶瘤病毒递送挑战 研究证实:MSC-OV可治疗多种癌症 基于MSC的溶瘤腺病毒(oAds)递送:由于oAds的复制可能仅限于恶性细胞,因此这些病毒疗法正在临床试验中评估用于治疗多种恶性肿瘤。当前已有研究发现间充质干细胞最终通过oAd复制裂解,从而避免了与体内干细胞活力相关的任何负面副作用。体内研究表明受感染的MSC可有效且特异性地将ICOVIR15和Ad.iC9的组合转运至肺部肿瘤部位,从而特异性地提高总生存率和肿瘤控制[5]。此外,另一项研究表明,肝细胞癌靶向的oAd可以成功修饰到MSC中,载有oAd的MSC不仅可以通过病毒增殖来抑制癌细胞扩增,降低肝毒性,还具有较高的安全效率[6]。 基于MSC的溶瘤单纯疱疹病毒(oHSV)递送:oHSV与间充质干细胞联合使用已被广泛评估,在治疗神经胶质瘤、转移性黑色素瘤、乳腺癌和卵巢癌方面显示较强的潜力。在脑肿瘤小鼠模型中,Du等人利用MSCs作为oHSV的细胞载体,发现MSC-oHSV可有效检测脑转移性肿瘤沉积物,抑制脑肿瘤发展,延长生存期[7]。 基于MSC的溶瘤麻疹病毒(oMV)递送:oMV存在于各种人类肿瘤异种移植物中,具有显著的抗癌潜力,正在多项I期临床研究中作为创新的肿瘤疗法进行研究。当前已有实验证明了oMV在肝癌、卵巢癌、白血病、骨髓瘤小鼠中存在较强的治疗作用。在肝癌、卵巢癌淋巴细胞白血病小鼠模型中静脉单次注射携带MV的MSC,病毒不会受到预先存在的抗病毒抗体的中和,具有很好的疗效[8、9]。 基于MSC的溶瘤粘液瘤病毒(MYXY)递送:BM-MSC也被证明可以作为MYXV载体来治疗小鼠恶性肿瘤。如在肺黑色素瘤小鼠以及原位胰腺导管腺癌(PDAC)小鼠中,输注装载MYXV的MSC(MYXY)后,癌症小鼠的存活率增加,肿瘤逐渐消退,免疫相关细胞增加,表明了MYXY的抗癌潜力[10]。 基于MSC的溶瘤呼肠孤病毒递送:包括急性髓系白血病在内的多种人类恶性肿瘤均可采用装载呼肠孤病毒的MSC来治疗,且当前已有相关产品面世:Reolysin®是一种用于胰腺、卵巢和恶性神经胶质瘤的新型全身给药抗癌药物,于2015年获得FDA批准。装载呼肠孤病毒(ReoT3D)的MSC在入直肠癌小鼠中具有较强的根除癌细胞能力[11]。 [4]MSC-OV作用机制 (3)临床试验:越来越多癌症使用MSC-OV治疗 当前,只有少数临床试验使用MSC-OV用于治疗癌症患者。第一个试验使用CELYVIR(X射线照射的携带ICOVIR-5的自体MSC)治疗小儿难治性神经母细胞瘤[12],结果发现一部分患者在接受输注后出现了不同程度的缓解,且治疗期间及随访期间未出现药物毒性及不良事件,表明MSC-OV治疗的有效性及安全性。 另外还有正在进展中的临床试验。一项I/II期临床试验(NCT02068794)正在评估使用溶瘤性麻疹病毒的的脂肪MSC对复发性卵巢癌、原发性腹膜癌或输卵管癌的治疗作用、不良反应以及最佳剂量。 另一项I期临床试验(NCT03896568)评估了溶瘤腺病毒DNX-2401负载的hBM-MSC通过动脉内给药治疗复发性高级别胶质瘤患者的最佳剂量和副作用。此外,在I/II期临床试验(NCT05047276)中检查了AloCELYVIR在转移性葡萄膜黑色素瘤肝转移患者中的安全性和有效性。 期待这些临床试验的结果! [4]MSC-OV在癌症患者中的应用临床试验 虽然MSC作为OV的细胞载体的研究数量有限,但当前大部分结果看上去前景很好。值得注意的是,目前对于MSC运载溶瘤病毒治疗实体肿瘤的研究大多还是处于初期阶段,还必须通过长期的深入研究和大量的临床研究数据加以证明其安全性和有效性。 路径三: 间充质干细胞抑制癌症药物副作用 大阪大学相关研究人员发现[13]:免疫检查点抑制剂被广泛用于治疗多种癌症,但其存在着一个严重的副作用,便是1型糖尿病的发作。现在,大阪大学的研究人员发现间充质干细胞疗法可以防止这种副作用。 大阪大学Emi Kawada-Horitani等研究人员构造了贴近免疫抑制剂副作用1型糖尿病的小鼠模型,将人脂肪来源的间充质干细胞通过尾静脉注射入小鼠体内,在造模后第16天分析了胰腺的组织学,发现接受了间充质干细胞注射的小鼠胰岛大多保持其正常形态以及胰岛素积极性,而没有接受治疗的小鼠胰岛则出现了变形及部分缺失。 在当定量胰腺切片中残留的胰岛β细胞面积时,发现间充质干细胞组的小鼠胰岛β细胞远高于没有接受治疗的小鼠,证实了间充质干细胞对于胰岛以及胰岛β细胞的保护、修复作用。 来自文献14 接下来,研究人员研究了注射的间充质干细胞的组织定位、血浆外泌体水平。组织定位发现胰腺、脾脏以及肝脏中很少或没有可见的做了荧光标记的间充质干细胞,而在血浆中发现间充质干细胞衍生的外泌体,据此猜测间充质干细胞可能是通过分泌相关因子来达到修复胰岛细胞的作用。 运用间充质干细胞来抑制癌症药物副作用时还可以收获一个好处,便是间充质干细胞及其分泌因子同时也会对于癌症起着一定的治疗作用,一举两得。 参考文献: [1] Vicinanza C, Lombardi E, Da Ros F, et al. Modified mesenchymal stem cells in cancer therapy: A smart weapon requiring upgrades for wider clinical applications. World J Stem Cells. 2022;14(1):54-75. doi:10.4252/wjsc.v14.i1.54 链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8788179/ [2] Ghasempour E, Hesami S, Movahed E, Keshel SH, Doroudian M. Mesenchymal stem cell-derived exosomes as a new therapeutic strategy in the brain tumors. Stem Cell Res Ther. 2022 Dec 20;13(1):527. doi: 10.1186/s13287-022-03212-4. PMID: 36536420; PMCID: PMC9764546. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9764546/ [3] Nadesh R, Menon KN, Biswas L, Mony U, Subramania Iyer K, Vijayaraghavan S, Nambiar A, Nair S. Adipose derived mesenchymal stem cell secretome formulation as a biotherapeutic to inhibit growth of drug resistant triple negative breast cancer. Sci Rep. 2021 Dec 6;11(1):23435. 链接:https://pubmed.ncbi.nlm.nih.gov/34873206/ [4] Ghasemi Darestani, Nadia et al. “Mesenchymal stem cell-released oncolytic virus: an innovative strategy for cancer treatment.” Cell communication and signaling : CCS vol. 21,1 43. 24 Feb. 2023, doi:10.1186/s12964-022-01012-0 [5] Hoyos V, et al. Mesenchymal stromal cells for linked delivery of oncolytic and apoptotic adenoviruses to non-small-cell lung cancers. Mol Ther. 2015;23(9):1497–1506. doi: 10.1038/mt.2015.110 [6] Yoon A-R, et al. Mesenchymal stem cell–mediated delivery of an oncolytic adenovirus enhances antitumor efficacy in hepatocellular carcinoma. Cancer Res. 2019;79(17):4503–4514. doi: 10.1158/0008-5472.CAN-18-3900 [7] Du W, et al. Stem cell-released oncolytic herpes simplex virus has therapeutic efficacy in brain metastatic melanomas. Proc Natl Acad Sci. 2017;114(30):E6157–E6165. doi: 10.1073/pnas.1700363114 [8] Mader EK, et al. Mesenchymal stem cell carriers protect oncolytic measles viruses from antibody neutralization in an orthotopic ovarian cancer therapy model. Clin Cancer Res. 2009;15(23):7246–7255. doi: 10.1158/1078-0432.CCR-09-1292 [9] Castleton A, et al. Human mesenchymal stromal cells deliver systemic oncolytic measles virus to treat acute lymphoblastic leukemia in the presence of humoral immunity. Blood J Am Soc Hematol. 2014;123(9):1327–1335 [10] Jazowiecka-Rakus J, et al. Myxoma virus expressing LIGHT (TNFSF14) pre-loaded into adipose-derived mesenchymal stem cells is effective treatment for murine pancreatic adenocarcinoma. Cancers. 2021;13(6):1394. doi: 10.3390/cancers13061394 [11] Babaei A, et al. Mesenchymal stem cells loaded with oncolytic reovirus enhances antitumor activity in mice models of colorectal cancer. Biochem Pharmacol. 2021;190:114644. doi: 10.1016/j.bcp.2021.114644 [12] Ruano D, et al. First-in-human, first-in-child trial of autologous MSCs carrying the oncolytic virus Icovir-5 in patients with advanced tumors. Mol Ther. 2020;28(4):1033–42. [13] https://www.sciencedaily.com/releases/2022/05/220505085613.htm [14] Kawada-Horitani, Emi et al. “Human adipose-derived mesenchymal stem cells prevent type 1 diabetes induced by immune checkpoint blockade.” Diabetologia, 10.1007/s00125-022-05708-3. 5 May. 2022. 链接:https://pubmed.ncbi.nlm.nih.gov/35511238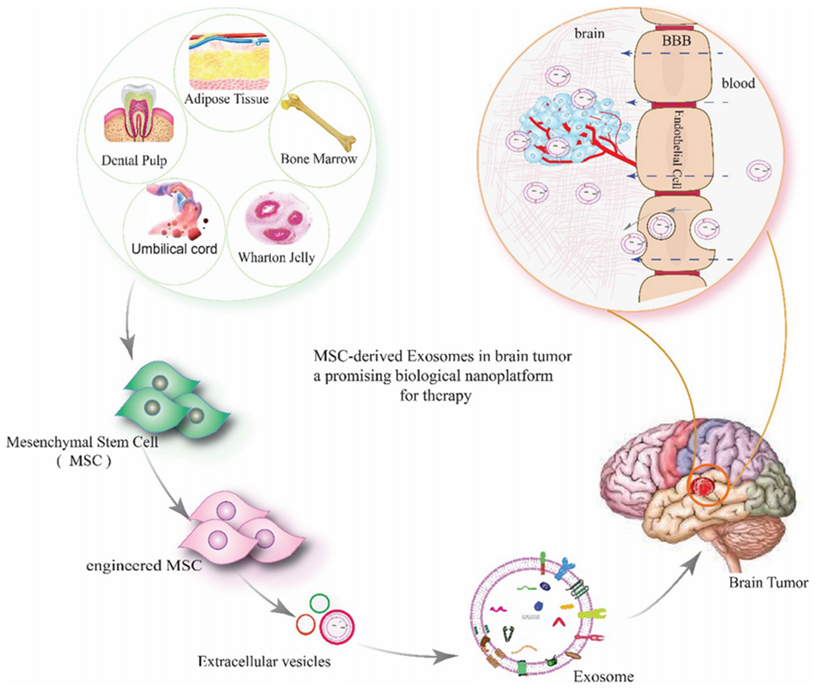






小结
间充质干细胞疗法已经在越来越多临床试验中被应用。其不仅可以用来治疗癌症,还可以抑制癌症药物副作用,为间充质干细胞疗法带来了新的机遇,相信在后续不断研究中,间充质干细胞治疗抗癌将会逐渐走向临床,成为人类抗癌的利器。
博雅新闻

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询




服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
